
现行的长式周期表,由左到右为18个纵行,碱金属族为第1纵行,稀有气体为第18纵行。按这个规定,下列说法中不正确的是
A.第10纵行中肯定没有非金属元素
B.第3纵行中元素种类最多
C.计算机芯片的组成元素位于第14纵行
D.第1纵行元素单质从上到下熔点逐渐降低,第17纵行元素单质从上到下熔点逐渐
升高
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
下列装置和操作能达到实验目的的是
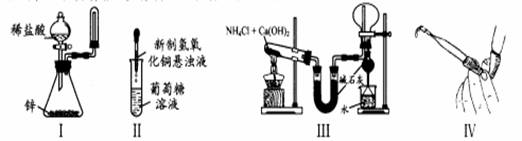
A.实验I:制取并收集氢气
B.实验II:验证葡萄糖的还原性
C.实验III:实验室制氨气并收集干燥的氨气
D.实验Ⅳ:检查碱式滴定管是否漏液
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁发生电化腐蚀时,正极上发生的反应是
A.2H++2e-=H2↑ B.2H2O+O2+4e-=4OH-
C.Fe-2e-=Fe2+ D.4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
在某一容积为5 L的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:

(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min)-1,该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有 (填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L。
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数______(填“升高”、“降低”还是“不变”)。
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于a、b、c、d四块金属片,若a、b用导线相连浸泡在稀H2SO4中,电子由a流向b;c、d用导线相连浸泡在稀H2SO4时,d产生大量气泡;a、c用导线相连浸泡在稀CuSO4中时,c上附着上一层红色物质;d浸泡在b的硝酸盐溶液中,置换出b的单质。则这四种金属的活动顺序由大到小为
A. a>b>c>d B. a>c>d>b C. c>a>b>d D. b>d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应的热现象的说法不正确的是:
①放热反应发生时不必加热
②化学反应发生过程中一定有能量变化
③吸热反应需要加热后才能发生
④化学反应吸收或放出热量的多少与参加反应的物质的量有关
A. ①② B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 向AgI沉淀中滴入饱和KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | 向某溶液加入CCl4 | 液体分层,下层CCl4显紫色 | 原溶液中存在I- |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com