
| A. | 常温常压下,92 g NO2和N2O4混合气体含有的原子数为6 NA | |
| B. | 5.6 g金属铁与足量稀盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,ll.2 LSO3含有的分子数为0.5 NA | |
| D. | 25℃、101 kPa时,64 g SO2中含有的氧原子数为3 NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、求出铁的物质的量,然后根据铁和盐酸反应后变为+2价来分析;
C、标况下三氧化硫为固体;
D、求出二氧化硫的物质的量,然后根据二氧化硫中含2个氧原子来分析.
解答 解:A、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO2的物质的量为2mol,故含6NA个原子,故A正确;
B、5.6g铁的物质的量为0.1mol,而铁和盐酸反应后变为+2价,故0.1mol铁失去0.2NA个电子,故B错误;
C、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、64g二氧化硫的物质的量为1mol,而二氧化硫中含2个氧原子,故1mol二氧化硫中含2NA个氧原子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:实验题
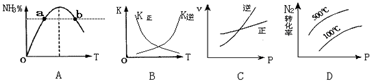
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、CO32-、NO3- | B. | Mg2+、NH4+、SO42-、Cl- | ||
| C. | Fe3+、K+、NO3-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除水垢 | |
| B. | 甘油加水作护肤剂 | |
| C. | 双氧水漂白美容 | |
| D. | 烹鱼时,加入少量的料酒和食醋可减少腥味,增加香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学变化一定伴随着能量变化 | |
| B. | 升高温度或加入催化剂,可以改变化学反应的反应热 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖可水解生成2mol乳酸(C3H6O3) | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. |  nOH的结构中含有酯基 nOH的结构中含有酯基 | |
| D. | 油脂和蛋白质都是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
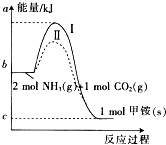 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如图所示.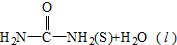 △H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=
△H=+dkJ•mol-1,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为CO2(g)+2NH3(g)=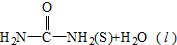 ,△H=(-b+c+d)KJ/mol.
,△H=(-b+c+d)KJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com