
 ,沸点196.5℃.请回答下列问题:
,沸点196.5℃.请回答下列问题: 的沸点>196.5℃.(填“>”、“<”或“=”)原因是
的沸点>196.5℃.(填“>”、“<”或“=”)原因是 能形成分子间氢键,
能形成分子间氢键, 能形成分子内氢键,分子间氢键能提高物质的沸点
能形成分子内氢键,分子间氢键能提高物质的沸点分析 (1) 能形成分子内氢键,
能形成分子内氢键, 则形成分子间氢键;分子间氢键能提高物质的沸点;
则形成分子间氢键;分子间氢键能提高物质的沸点;
(2) 中苯环上的碳原子按sp2杂化,醛基中碳原子含有碳氧双键,所以碳原子按sp2杂化,根据-OH和-CHO中氧原子的价层电子对数判断氧原子杂化方式;
中苯环上的碳原子按sp2杂化,醛基中碳原子含有碳氧双键,所以碳原子按sp2杂化,根据-OH和-CHO中氧原子的价层电子对数判断氧原子杂化方式;
(3)分子式为C7H6O3Cl的芳香族化合物,即该分子中有苯环,苯环上有3个不同的取代基,据此可写结构简式.
解答 解:(1)分子间氢键能提高物质的沸点, 能形成分子内氢键,
能形成分子内氢键, 则形成分子间氢键,所以
则形成分子间氢键,所以 的沸点小于
的沸点小于 ,
,
故答案为:>; 能形成分子间氢键,
能形成分子间氢键, 能形成分子内氢键,分子间氢键能提高物质的沸点;
能形成分子内氢键,分子间氢键能提高物质的沸点;
(2) 中苯环上的碳原子按sp2杂化,醛基中碳原子含有碳氧双键,所以碳原子按sp2杂化,-OH中氧原子的价层电子对数为$\frac{6+2}{2}$=4,所以氧原子按sp3方式杂化,-CHO中碳氧双键,所以氧原子的杂化方式是sp2,
中苯环上的碳原子按sp2杂化,醛基中碳原子含有碳氧双键,所以碳原子按sp2杂化,-OH中氧原子的价层电子对数为$\frac{6+2}{2}$=4,所以氧原子按sp3方式杂化,-CHO中碳氧双键,所以氧原子的杂化方式是sp2,
故答案为:sp2;sp3;sp2;
(3)分子式为C7H6O3Cl的芳香族化合物,即该分子中有苯环,苯环上有3个不同的取代基,则苯环上连有-OH、-COOH、-Cl三种基团,根据定二动一的方法,符合条件的同分异构体有10种,
故答案为:10.
点评 本题主要考查了有机官能团中涉及氢键的知识及原子杂化方式和同分异构体的知识,难度中等,答题时注意常见有机物官能团的结构与性质.


科目:高中化学 来源: 题型:解答题
 铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对处于平衡状态的2HI(g)?H2(g)+I2(g)反应,缩小体积后混合物颜色变深 | |
| B. | 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数减小 | |
| C. | 对于可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)达到平衡后,向反应体系中加入KCl固体,平衡向逆反应方向移动 | |
| D. | 合成氨时适当增大压强有利于提高氢气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
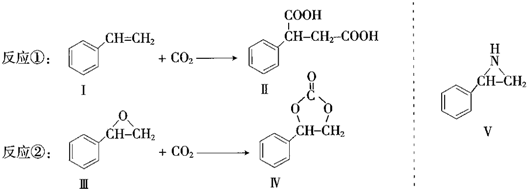
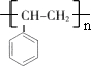 .
.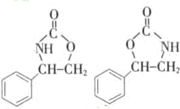 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
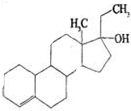 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )| A. | 该物质可以视为烃类 | B. | 该有机物的分子式为C20H32O | ||
| C. | 不能使溴的四氯化碳溶液褪色 | D. | 该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
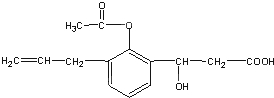 某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.
某有机物的结构简式如图:则此有机物可发生的反应有( )①取代 ②加成③氧化④酯化 ⑤水解⑥中和.| A. | ①②③⑤ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 2使溴的四氯化碳溶液褪色; ②比例模型为 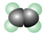 ③能与水在一定条件下反应生成C |
| B | 2C、H两种元素组成; ②球棍模型为  |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2; ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成;②其水溶液能使紫色石蕊试液变红; ③可由C发生氧化反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素Y在周期表中位于第ⅣA族.
;元素Y在周期表中位于第ⅣA族.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com