
| m |
| 32 |
| m |
| 8 |
| m |
| 8 |
| m |
| 8 |
| m |
| 4 |


科目:高中化学 来源: 题型:
 -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是: -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol  -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表: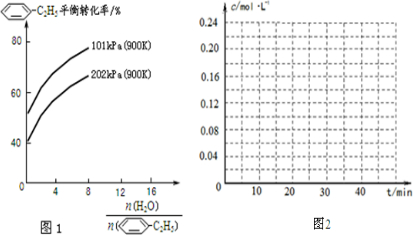
| 时间/min | 0 | 10 | 20 | 30 | 40 |
n( -C2H5)/mol -C2H5)/mol |
0.40 | 0.30 | 0.26 | n2 | n3 |
n( -CH=CH2)/mol -CH=CH2)/mol |
0.00 | 0.10 | n1 | 0.16 | 0.16 |
 -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的浓度c随时间t变化的曲线
-CH=CH2(g)的浓度c随时间t变化的曲线

查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省湖州市高二(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源: 题型:
用某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液)电解饱和亚硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极。下列说法正确的是
![]() A.当燃料电池正极消耗mg气体时,电解池阴极同时有mg气体生成
A.当燃料电池正极消耗mg气体时,电解池阴极同时有mg气体生成
![]() B.电解池的阳极反应式为:
B.电解池的阳极反应式为: ![]()
![]() C.电解池中溶液pH变小
C.电解池中溶液pH变小
![]() D.燃料电池中溶液pH变大
D.燃料电池中溶液pH变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com