
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、是戊酸,同分异构体有4种 |
| B、是酯,在稀硫酸条件下水解的两种产物的相对分子质量不可能相等 |
| C、可以发生银镜反应 |
| D、可以与溴水发生加成反应 |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
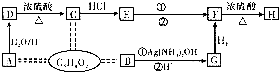
查看答案和解析>>
科目:高中化学 来源: 题型:
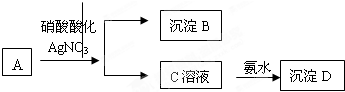
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在混合物中加入盐酸,充分振荡,再用分液漏斗分离 |
| B、在混合物中加入NaOH溶液,充分振荡,再通入过量CO2气体,待完全反应后,用分液漏斗分离 |
| C、将混合物用蒸馏方法分离 |
| D、在混合物中加入乙醚,充分振荡,萃取苯酚,然后再用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、③⑤ |
| C、②③⑥ | D、④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com