
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水 ①>②>③ | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| D. | pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③ |
分析 A.根据硫酸氢钠溶液的电荷守恒和物料守恒进行分析;
B.酸或碱抑制水电离、能水解的盐促进水电离;
C.强碱弱酸盐中对应的酸性越强,水解程度越小;
D.pH相同时,盐的水解程度越大,盐的浓度越小.
解答 解:A.根据硫酸氢钠溶液中的电荷守恒得:c(H+)+c(Na+)=c(OH-)+2c(SO42-),根据物料守恒得c(Na+)=c(SO42-),所以得c(H+)=c(OH-)+c(SO42-),故A正确;
B.pH=5的CH3COOH溶液和稀盐酸,二者中氢离子浓度相同,对水的抑制程度相同,则水电离的氢离子浓度相同,NH4Cl水解促进水的电离,所以由水电离出来的c(H+)水 ①>②=③,故B错误;
C.pH相等时,强碱的浓度最小,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸的酸性小于醋酸的,所以浓度相同时Na2CO3的pH大,则pH相同时Na2CO3的浓度小,即浓度顺序是c(NaOH)<c(Na2CO3)<c(CH3COONa),故C正确;
D.pH相同时,盐的水解程度越大,盐的浓度越小,则c(Na+):①>②>③,故D正确.
故选B.
点评 本题考查盐类水解、pH的计算等,明确酸碱混合的计算,盐类水解的规律、pH与浓度的关系等知识即可解答,题目难度不大,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:解答题
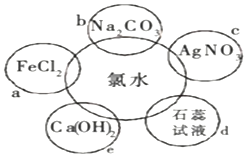 完成下列题目
完成下列题目查看答案和解析>>
科目:高中化学 来源: 题型:选择题
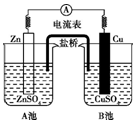
| A. | 电子由Zn极流向Cu极 | B. | 此装置能将电能转变为化学能 | ||
| C. | 取出盐桥,电流表指针不再偏转 | D. | 该装置的总反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
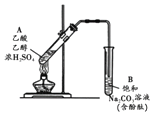 某同学利用如图所示装置制备乙酸乙酯.实验如下:
某同学利用如图所示装置制备乙酸乙酯.实验如下:| A. | ①中加热利于加快酯化反应速率,故温度越高越好 | |
| B. | ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致 | |
| C. | ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中 | |
| D. | 取②中上层油状液体测其核磁共振氢谱,共有3组峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )
PH=1的两种溶液A、B各1mL,分别加水稀释到1000mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法正确的是( )| A. | ①④ | B. | ②③ | C. | ①② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+ )>c(OH? )=c(H+) | |
| D. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl- )+c(ClO- )+c(OH? ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,这利用了胶体的渗析原理 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 化工厂可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
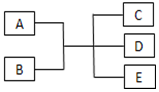 已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com