
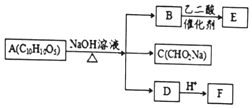
 某芳香化合物A有如下转化:
某芳香化合物A有如下转化: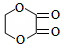 1mol F 最多消耗2mol NaOH.
1mol F 最多消耗2mol NaOH.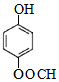
分析 A的分子式为C10H10O5,不饱和度为$\frac{2×10+2-10}{2}$=6,遇FeCl3溶液不显紫色,且苯环上有两个取代基,则属于芳香族化合物,没有酚羟基,在氢氧化钠溶液条件下反应得到B、C、D,C的化学式为CHO2Na,则C为HCOONa,B的1H核磁共振谱图中有2组特征峰,并且B与乙二酸反应生成E,E是六元环状有机物,所以B为HOCH2CH2OH,E为 ,所以A为
,所以A为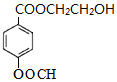 ,D为
,D为 ,F为
,F为 ,据此解答.
,据此解答.
解答 解:(1)根据以上分析,A为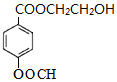 ,含氧官能团有醛基、脂基和羟基,故答案为:羟基;
,含氧官能团有醛基、脂基和羟基,故答案为:羟基;
(2)根据以上分析,B为HOCH2CH2OH,物质的名称为乙二醇,1m0l B与足量金属钠充分反应最多可生成1mol氢气,C为HCOONa,含有醛基,所以在一定条件下能发生银镜反应,E的结构简式为 ,F为
,F为 ,则1mol F 最多消耗2mol NaOH,①能发生银镜反应和水解反应,说明含有醛基和酯基即甲酸酯;②遇FeCl3溶液显紫色,含酚羟基;③分子中只有4种不 同化学环境的氢,则一般为对位结构,所以符合条件的结构简式:
,则1mol F 最多消耗2mol NaOH,①能发生银镜反应和水解反应,说明含有醛基和酯基即甲酸酯;②遇FeCl3溶液显紫色,含酚羟基;③分子中只有4种不 同化学环境的氢,则一般为对位结构,所以符合条件的结构简式: ;
;
故答案为:乙二醇;1;能; ;2;
;2; .
.
点评 本题考查有机物推断,涉及酯的水解等的性质,有机物的结构的推导等,有一定的综合性,难度中等.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
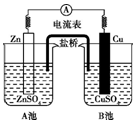
| A. | 电子由Zn极流向Cu极 | B. | 此装置能将电能转变为化学能 | ||
| C. | 取出盐桥,电流表指针不再偏转 | D. | 该装置的总反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH- )=c(CH3COO-)-c(CH3COOH) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+ )>c(OH? )=c(H+) | |
| D. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl- )+c(ClO- )+c(OH? ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗,这利用了胶体的渗析原理 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装中放入生石灰或硅胶 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 化工厂可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$→_{点燃}^{CO_{2}}$Na2CO3 | |
| B. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| C. | Al2O3$\stackrel{H_{2}O}{→}$Al(OH)3$\stackrel{盐酸}{→}$AlCl3 | |
| D. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
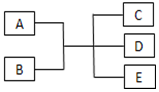 已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中阴离子的个数为2NA | |
| B. | Na2O2与H2O反应生成1.12L(标准状况)气体,反应中转移的电子数为0.2NA | |
| C. | 1mol氯气溶于足量水中,转移的电子数为NA | |
| D. | 在1 L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com