
| 实验序号 | 温度 /℃ | H2O2溶液 初始浓度/% | MnO2 颗粒大小 |
| 1 | 25 | 4 | 无MnO2 |
| 2 | 25 | 12 | 1g细颗粒MnO2 |
| 3 | 25 | 4 | 1g细颗粒MnO2 |
| 4 | 25 | 4 | 1g粗颗粒MnO2 |
分析 (1)浓度越大反应速率越快,使用催化剂反应速率加快,催化剂颗粒越小,接触面积越大,反应速率越快;
(2)实验3、4中催化剂颗粒大小不同,探究催化剂颗粒大小对反应速率的影响;
(3)实验2、3中过氧化氢的浓度不同,探究浓度对反应速率的影响;
(4)控制其他条件相同,改变温度.
解答 解:(1)温度都相同,实验2的浓度最大,催化剂为细颗粒,反应速率最快,故答案为:2;
(2)实验3、4中催化剂颗粒大小不同,探究催化剂颗粒大小对反应速率的影响,催化剂颗粒越小,接触面积越大,反应速率越快,
故答案为:催化剂颗粒越小,化学反应速率越大;
(3)实验2、3中其它条件相同,只有过氧化氢的浓度不同,探究浓度对化学反应速率的影响,
故答案为:探究浓度对化学反应速率的影响;
(4)探究温度对反应速率的影响,应取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢,
故答案为:取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢.
点评 本题多角度考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
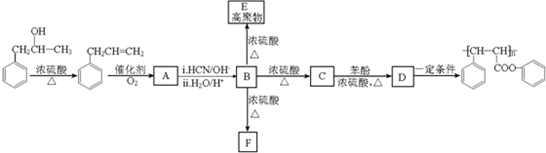

 .
. 生成A的化学方程式为
生成A的化学方程式为 +O2$\stackrel{催化剂}{→}$
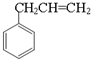
+O2$\stackrel{催化剂}{→}$ +HCHO.
+HCHO.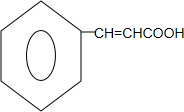 +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. (任写一种结构简式).
(任写一种结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向稀的苯酚水溶液中滴加饱 和溴水 | 生成白色沉淀 | 产物三溴苯酚溶于水 |
| C | 向含I-的无色溶液中滴加少量铁盐溶液,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Fe3+>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1的盐酸中,含HCl分子数为NA | |
| B. | 0.1mol Na2O2与水完全反应,转移0.2NA个电子 | |
| C. | 8.4gNaHCO3固体中含HCO3-数目为0.1NA | |
| D. | 将含Na+数目为NA的NaCl固体溶于1L水中,所得溶液的浓度为1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com