
| ||
| ||
| A、①②两反应都是氧化还原反应 |
| B、①②两反应中的能量转换方式都是热能转变为化学能 |
| C、②反应是电能转变为化学能 |
| D、①反应是热能转变为化学能 |
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省油田高中高一下学期期中考试化学试卷(带解析) 题型:填空题
(8分)有如下两个反应: A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A B (填“能”或“不能”)不能设计成原电池的原因是
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是
②写出负极的电极反应式
③若导线上转移电子0.2mol,则负极质量变化是
查看答案和解析>>
科目:高中化学 来源:2012届重庆市高三考前模拟测试理科综合试题化学试卷(带解析) 题型:实验题
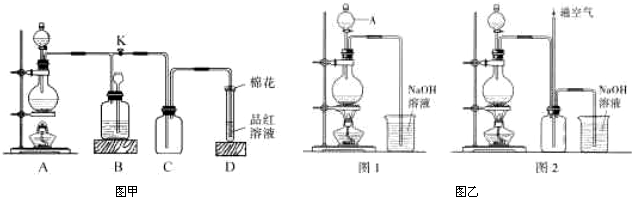
(15分)甲、乙两同学分别都用到铜与硫酸完成下列相关实验,请回答相应的问题.
(1)甲同学用题27-1图所示装置实现铜跟浓硫酸反应制取少量硫酸铜溶液,并验证相关物质的性质.
①装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是_____.
②从C、D装置中观察到的现象,说明上述反应的某种生成物所具有的化学性质是 、__ __.
③装置B将用来储存多余气体,当D处有明显的现象后,关闭旋塞K.,打开K2移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_ .
(2)乙同学认为:铜虽不能与稀硫酸直接反应生成硫酸铜,但可以在稀硫酸与铜粉的混合物中分多次加入适量浓硝酸而得到不含NO3—的硫酸铜溶液.其装置如题27-2图所示.
①把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是____
②已知NO不能被NaOH溶液直接吸收:但已知有如下两个反应:

题27-3图是题27-2图的改进装置,其优点除可以防止倒吸外还有___ _
③将反应所得硫酸铜溶液经___ _、 、过滤、洗涤、干燥即可得到胆矾晶体.
④如果用1mol Cu来制取lmol CuSO4,则所需浓硝酸中HNO3的质量为 _,(假设HNO3的还原产物全为NO),若所得尾气恰好被NaOH溶液吸收并生成NaNO2,需通入空气的体积为____.(假设气体体积为标准状况下测定,空气中氧气占总体积的 ,保留小数点后一位,并忽略装置中原有空气的影响)
,保留小数点后一位,并忽略装置中原有空气的影响)
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:填空题
(10分)有如下两个反应
A:2HCl+Ba(OH)2=BaCl2+2H2O B:2Fe3++Cu=2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A ,B ,(填“能”或“不能”)不能设计成原电池的原因是 ;
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是 ;
②写出负极的电极反应式 ;
③若导线上转移电子0.2 mol,则负极质量减少 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com