
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
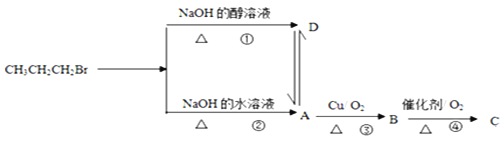
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
【答案】CH3CH=CH2 CH3CH2CH2Br + NaOH![]() CH3CH2CH2OH + NaBr 2CH3CH2CH2OH+2Na→2CH3CH2CH2ONa + H2↑ 醛基 D CH3CH2CHO+2Cu(OH)2+NaOH
CH3CH2CH2OH + NaBr 2CH3CH2CH2OH+2Na→2CH3CH2CH2ONa + H2↑ 醛基 D CH3CH2CHO+2Cu(OH)2+NaOH![]() CH3CH2COONa+Cu2O↓+3H2O
CH3CH2COONa+Cu2O↓+3H2O
【解析】
1—溴丙烷在氢氧化钠醇溶液中加热发生消去反应生成D为CH3CH=CH2,在氢氧化钠水溶液中加热发生水解反应生成A为CH3CH2CH2OH,A发生催化氧化生成的B为CH3CH2CHO,B发生氧化反应生成的C为CH3CH2COOH,以此解答该题。
1—溴丙烷在氢氧化钠醇溶液中加热发生消去反应生成D为CH3CH=CH2,在氢氧化钠水溶液中加热发生水解反应生成A为CH3CH2CH2OH,A发生催化氧化生成的B为CH3CH2CHO,B发生氧化反应生成的C为CH3CH2COOH;
(1)D为丙烯,其结构简式为CH3CH=CH2,反应②为1—溴丙烷在NaOH的水溶液中水解生成1—丙醇,发生反应的化学反应方程式为CH3CH2CH2Br + NaOH![]() CH3CH2CH2OH + NaBr;
CH3CH2CH2OH + NaBr;
(2)有机物A为1—丙醇,与金属钠反应生成氢气和1—丙醇钠,发生反应的化学方程式为2 CH3CH2CH2OH+2Na→2 CH3CH2CH2ONa + H2↑;
(3)B为CH3CH2CHO,含有的官能团是醛基,利用醛基能与新制的氢氧化铜悬浊液混合加热生成砖红色沉淀来检验醛基的存在,故答案为D;丙醛与与新制的氢氧化铜悬浊液混合加热,发生反应的化学方程式为CH3CH2CHO+2Cu(OH)2+NaOH![]() CH3CH2COONa+Cu2O↓+3H2O。
CH3CH2COONa+Cu2O↓+3H2O。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”。已知它易溶于水,难溶于乙醇,在中性或碱性环境中稳定,受热、遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
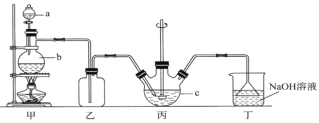
(1)装置甲中,a仪器的名称是____________;a中盛有浓硫酸,b中盛有亚硫酸钠,实验中要控制SO2生成速率,可以采取的措施有_________________________(写出一条即可)。
(2)装置乙的作用是____________________________________。
(3)装置丙中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。反应的化学方程式为:________________________________________。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为_________。(实验中供选用的试剂及仪器:CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管.提示:室温时CaCO3饱和溶液的pH=9.5)
(5)反应结束后过滤丙中的混合物,滤液经蒸发、结晶、过滤、洗涤、干燥等得到产品,生成的硫代硫酸钠粗品可用_____________洗涤。为了测定粗产品中Na2S2O3·5H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应)。称取1.50g粗产品溶于水,用0.20 mol·L-1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中![]() 全部被氧化为
全部被氧化为![]() 时,消耗高锰酸钾溶液体积40.00mL。
时,消耗高锰酸钾溶液体积40.00mL。
①写出反应的离子方程式:________________________________________。
②产品中Na2S2O3·5H2O的质量分数为____________________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”(主要成分为NaClO)能有效杀灭新型冠状病毒,某化学小组对“84消毒液”的制备和性质进行研究。请回答下列问题:
I.甲同学查阅资料知道可以利用氯气与氢氧化钠溶液反应制取“84消毒液”,同时发现“在加热情况下卤素与碱液发生如下反应:3X2+6OH-→5X-+XO3-+3H2O”。由此设计了如下装置。
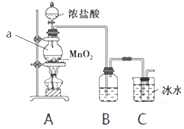
(1)仪器a的名称为__________,B中所用试剂为__________。
(2)A中发生反应的离子方程式为________。
(3)有同学认为该实验存在明显的缺陷,如何改进:________。
II.乙同学阅读某“84消毒液”的包装说明得到以下信息:
严禁与洁厕灵(主要成分盐酸)同时使用。
有效氯含量在5%以上。
有效氯含量用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征。
(1)“84消毒液”与洁厕灵同时使用会产生有毒的氯气,写出反应的离子方程式___。
(2)乙同学进行如下实验测定有效氯:
步骤一:取C中大试管溶液5 g于锥形瓶,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液。
步骤二:用0.1000 mol·L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
步骤一反应的离子方程式为________。通常选用__________作指示剂,滴定至终点的现象________。此消毒液有效氯含量为__________%(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g),下列可以判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中总压强不变
C. 密闭容器中混合气体的平均摩尔质量不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用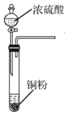 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用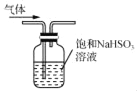 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用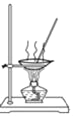 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
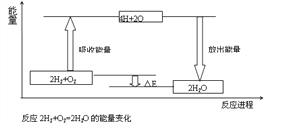
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

B. 配制FeCl3溶液

C. 淀粉在不同条件下水解

D. 探究石灰石与稀盐酸在密闭环境下的反应

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com