
分析 A.依据m=CV计算需要溶质物质的量;
B.依据m=nM计算溶质的质量;
C.依据移液的正确操作解答;
D.洗涤时,为防止溶质损耗,应将洗涤液全部转移到容量瓶中;
E.定容时,为防止蒸馏水加入过多,继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用滴管小心滴加至溶液凹液面底部与刻度线水平相切;
解答 解:A.配制500mL0.4mol/L的NaCl溶液,需要溶质的物质的量m=0.4mol/L×0.5L=0.2mol;
故答案为:0.2;
B.0.2mol氯化钠的质量m=0.2mol×58.5g/mol=11.7g;
故答案为:11.7;
C.移液的正确操作,应将溶解冷却后的溶液沿着玻璃棒引流到500mL容量瓶;
故答案为:玻璃棒 500;
D.洗涤时,为防止溶质损耗,应将洗涤液全部转移到容量瓶中;
故答案为:容量瓶;
E.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切;
故答案为:胶头滴管.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,题目难度不大.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:选择题

| A. | 吗替麦考酚酯的分子式为C23H30O7N | |
| B. | 吗替麦考酚酯可发生加成、取代、消去反应 | |
| C. | 吗替麦考酚酯分子中所有碳原子一定处于同一平面 | |
| D. | 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 实验室测定常温下l molH2的体积通常用如图所示的装置.
实验室测定常温下l molH2的体积通常用如图所示的装置.| 实验次数 | 镁带质量(g) | 硫酸体积( mL) | 氢气体积( mL) | l摩尔气体的体积(L)(精确到0.001L) |
| 1 | 0.050 | 10 | 49.0 | |
| 2 | 0.049 | 10 | 48.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维和光导纤维都是新型有机非金属材料 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | “玉不琢不成器”、“百炼方能成钢”发生的均为化学变化 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 乙烯能与高锰酸钾发生氧化还原反应 |
| B | 用Na2S除去废水中的Cu2+和Hg2+ | Na2S具有强还原性 |
| C | 用氧化铁制作红色涂料 | 氧化铁能与酸反应 |
| D | 用明矾溶液清除铜镜表面的铜锈 | 明矾溶液中Al3+能与铜锈反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y与Z的原子半径大小:Y>Z>X | |
| B. | 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子 | |
| C. | 元素X与元素Y形成的化合物是一种较好的耐火材料 | |
| D. | 元素X可与元素Z可组成3种二价阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
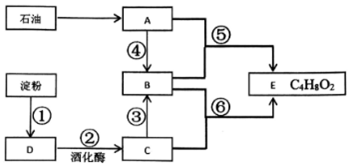
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
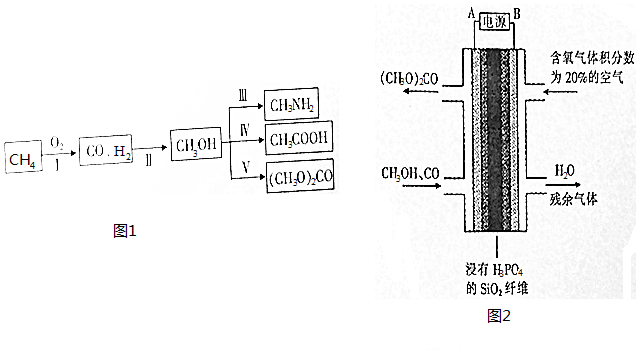
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com