
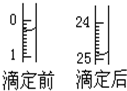
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | / | / | |
| 3 | V | 6.00 | 31.35 | 25.35 |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| 25.35mL+25.30mL |
| 2 |
| ||
| VmL |
| ||
| VmL |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、②③⑤④① |
| C、⑤①②③④ |
| D、⑤③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
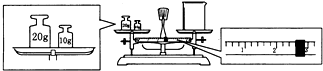 实验室欲用NaOH固体配制1.0mol?L-1的NaOH溶液240mL.
实验室欲用NaOH固体配制1.0mol?L-1的NaOH溶液240mL.查看答案和解析>>
科目:高中化学 来源: 题型:
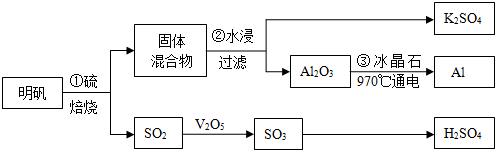
查看答案和解析>>
科目:高中化学 来源: 题型:
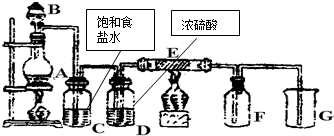 如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com