
| 温度0C化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
分析 (1)该电池的正极发生还原反应,MnO2被还原生成MnOOH;负极锌被氧化生成Zn2+,以此书写电池总反应式;
(2)每转移0.04mol电子,以此计算消耗锌的质量、物质的量;
(3)填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化;
(4)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,结合Ksp=10-39计算pH,并根据Ksp计算锌开始沉淀的pH.
解答 解:(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH,负极锌被氧化生成Zn2+,电池总反应式为2MnO2+Zn+2H+=2MnOOH+Zn2+,
故答案为:MnO2+H++e-=MnOOH;2MnO2+Zn+2H+=2MnOOH+Zn2+;
(2)每转移0.04mol电子,则消耗Zn的质量为0.04×$\frac{1}{2}$×65g/mol=1.3g,故答案为:1.3;
(3)滤液中主要有ZnCl2和NH4Cl,可通过加热浓缩、冷却结晶得到晶体,填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰,
故答案为:加热浓缩、冷却结晶;碳粉;MnOOH;空气中加热;碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-39,
则c(OH-)=$\root{3}{\frac{10{\;}^{-39}}{1×10{\;}^{-5}}}$mol/L≈0.5×10-11mol/L,此时pH=2.7,
如锌开始沉淀,则c(OH-)=$\sqrt{\frac{10{\;}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:Fe3+;2.7;6;Zn2+和Fe2+分离不开;Zn(OH)2、Fe(OH)2的Ksp相近.
点评 本题考查原电池知识以及物质的分离、提纯,侧重于原电池的工作原理以及实验基本操作和注意问题,题目难度中等,有利于培养学生良好的科学素养.


科目:高中化学 来源: 题型:选择题
| A. | 称取1.06 g 无水碳酸钠,加入100ml容量瓶中,加水溶解、定容 | |
| B. | 称取1.06 g 无水碳酸钠,加入100ml蒸馏水,搅拌、溶解 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒个引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团:
(1)具有复合官能团的复杂有机物中官能团具有各自的独立性,在不同条件下所发生的化学反应可分别从各官能团讨论.如图;具有两种官能团: 和
和 (填化学式),所以这个化合物看作羧酸类和醛类.
(填化学式),所以这个化合物看作羧酸类和醛类. ,此烃的名称为3-甲基-2-乙基-1-戊烯
,此烃的名称为3-甲基-2-乙基-1-戊烯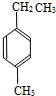 ,此烃名称为对甲基乙苯或4-甲基乙基苯
,此烃名称为对甲基乙苯或4-甲基乙基苯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化剂在反应中被氧化,还原剂在反应中被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | a和d互为同素异形体 | B. | b和c互为同系物 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com