
为提纯下列物质(括号内为少量杂质),所选除杂试剂与主要分离方法都正确的是
| 不纯物质 | 除杂试剂 | 分离方法 |
A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子数为4 mol
C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2
D.组装该电池必须在无水、无氧的条件下进行
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
设阿伏加德罗常数的值为NA,下列说法中正确的是
A.1 mol 苯乙烯中含有的C=C数为4 NA
B.2.8 g 乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
C.0.1 mol CnH2n+2中含有的C—C键数为0.1n NA
D.标准状况下,2.24 L CCl4含有的分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
某气态烃1 mol 恰好与2 mol HCl加成,生成物分子中的氢又可被6 mol Cl2取代,则此气态烃可能是
A.C2H2B.C2H4C.CH≡C—CH3D.CH2=C(CH3)2
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转化为铜蓝(CuS)。下列分析正确的是
A.CuS的溶解度大于PbS的溶解度,Ksp(ZnS)<Ksp(CuS)
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:简答题
(12分)W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题:
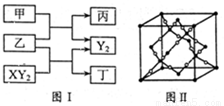
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省眉山市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.水玻璃长时间放置在空气中:SiO32-+CO2+H2O=H2SiO3↓+HCO3-
B.硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+
C.用石墨电极电解饱和食盐水:2H++2Cl-  H2↑+Cl2↑
H2↑+Cl2↑
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:实验题
树德中学某化学兴趣小组在实验室用MnO2与浓盐酸反应制备C12(发生装置如图所示)。
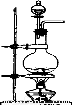
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 序号)。
A.往烧瓶中加入浓盐酸
B.加热
C.往烧瓶中加入MnO2粉末
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,兴趣小组同学提出下列实验探究方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量
乙方案:采用酸碱恰好中和(有指示剂)的方法测定
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量
丁方案:与足量Zn反应,测量生成的H2体积(换算为标准状况)
继而进行下列判断和实验:
①判定甲方案是否可行 (填“是”或“否”),理由是 。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,滴入0.200 0 mol/L的NaOH溶液,消耗NaOH溶液22.00 mL,该次测得试样中盐酸浓度为 mol·L一1;
b.重复以上操作多次取平均值获得实验结果
③判断丙方案的实验结果 (填“偏大"、“偏小”或“准确”)。
(已知:部分CaCO3会转化为更难溶的MnCO3)
④进行丁方案实验:装置如图所示(夹持器具已略去)
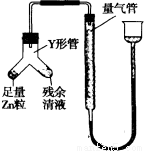
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔l分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com