
| 实验操作 | 预期现象及结论 |
| 取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则①II(填“I”“II”或“III”,下同)成立,若没有气泡产生,则②I或III成立 |
| 另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡 | ③溶液变为蓝色,则III成立 |
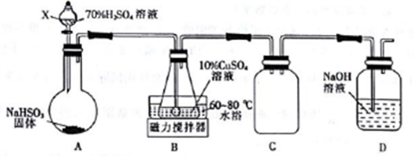
分析 Cu2SO3•CuSO3•2H2O是一种深红色固体,不溶于水和乙醇,100℃时发生分解,利用装置A亚硫酸氢钠和浓硫酸反应生成二氧化硫气体通过装置B中10%的硫酸铜溶液,水浴加热生成Cu2SO3•CuSO3•2H2O,装置C是防倒吸装置,装置D为吸收尾气防止污染空气,
(1)①X为分液漏斗,二氧化硫易溶于水,浓硫酸易于逸出;
②装置C为安全瓶;
③装置B中发生反应是二氧化硫和硫酸铜溶液反应生成Cu2SO3•CuSO3•2H2O和硫酸;
④Cu2SO3•CuSO3•2H2O100℃时发生分解;
(2)向NaHSO3溶液中加入NaClO溶液时,反应有I.NaHSO3和NaClO恰好反应:NaHSO3+NaClO=NaHSO4+NaCl;Ⅱ.NaClO不足:2NaHSO3+NaClO=Na2SO4+SO2↑+H2O+NaCl;Ⅲ.NaClO过量:NaHSO3+NaClO=Na2SO4+NaCl+HClO;据此分析步骤中的结论和现象;
(3)电离显酸性,水解显碱性,则测定pH即可.
解答 解:(1)①仪器X的名称是分液漏斗,常温下用装置A制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是SO2易溶于水,用较浓的硫酸有利于SO2的逸出,
故答案为:分液漏斗;SO2易溶于水,用较浓的硫酸有利于SO2的逸出;
②装置C的作用是安全瓶,防倒吸,
故答案为:防止倒吸;
③装置B中发生反应是二氧化硫和硫酸铜溶液反应生成Cu2SO3•CuSO3•2H2O和硫酸,反应的离子方程式为:3Cu2++3SO2+6H2O═Cu2SO3•CuSO3•2H2O↓+8H++SO42-,
故答案为:3Cu2++3SO2+6H2O═Cu2SO3•CuSO3•2H2O↓+8H++SO42-;
④从装置B中获得的固体需先用蒸馏水充分洗涤,再真空干燥,而不直接用烘干的方式得到产品,其原因是防止Cu2SO3•CuSO3•2H2O发生分解和被氧化,
故答案为:防止Cu2SO3•CuSO3•2H2O发生分解和被氧化;
(2)向NaHSO3溶液中加入NaClO溶液时,反应有I.NaHSO3和NaClO恰好反应:NaHSO3+NaClO=NaHSO4+NaCl;Ⅱ.NaClO不足:2NaHSO3+NaClO=Na2SO4+SO2↑+H2O+NaCl;Ⅲ.NaClO过量:NaHSO3+NaClO=Na2SO4+NaCl+HClO,
取上述反应后的混合溶液于试管 A中,滴加稀硫酸,若生成气体生命含亚硫酸氢钠,否则无亚硫酸氢钠;
①取上述反应后的混合溶液于试管 A中,滴加稀硫酸,若有气泡产生,则II:NaHSO3过量,
②故若没有气泡产生,I.NaHSO3和NaClO恰好反应,III.NaClO过量正确,
③另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡.HClO可氧化KI;2HClO+2KI=I2+KCl+KClO+H2O,溶液变为蓝色,则Ⅲ成立,
故答案为:
| 实验操作 | 预期现象及结论 |
| ①Ⅰ;②Ⅰ或Ⅲ | |
| ③溶液变为蓝色 |
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验装置、原理、物质的性质及反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
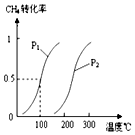 在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H
在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g).一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释或理论 |
| A | 把铁片投入浓硫酸 | 无明显变化 | 常温下铁不与浓硫酸反应 |
| B | 将浓硫酸滴到白纸上 | 白纸变黑 | 浓硫酸具有强氧化性,导致纸中的纤维素碳化 |
| C | 把二氧化硫通入溴水 | 溴水褪色 | 说明二氧化硫具有漂白性 |
| D | 用湿润的红色石蕊试纸检验某气体 | 试纸变蓝 | 该气体是氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:Y<Z | |
| C. | 工业上制备W单质的方法为热还原法 | |
| D. | X分别与Y、Z形成的简单化合物所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
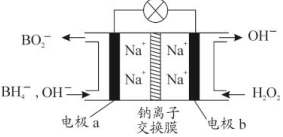 某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )| A. | 每消耗3mol H2O2,转移6mol e- | |
| B. | 电池工作时Na+从b极区移向a极区 | |
| C. | b极上的电极反应式为:H2O2+2e-═2OH- | |
| D. | a极上的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Al(OH)3 | B. | AgNO3、NH4Cl | C. | MgSO4、BaCl2 | D. | CuCl2、Al(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
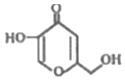
| A. | 分子中所有碳原子不可能共平面 | |
| B. | 能发生酯化反应、氧化反应、还原反应 | |
| C. | lmol该物质与H2完全加成,需消耗3mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com