
| A. | 1 mol H2O 的质量是18 g/mol | |
| B. | CH4 的摩尔质量是16 g | |
| C. | 标准状况下,1 mol 任何物质的体积均为22.4 L | |
| D. | 3.01×1023个O2分子的质量是16 g |
分析 A.1 mol H2O 的质量是18 g;
B.CH4 的摩尔质量是16 g/mol;
C.标况下物质并不都是气体;
D.根据n=$\frac{N}{{N}_{A}}$计算氧气物质的量,再根据m=nM计算氧气质量.
解答 解:A.H2O 的摩尔质量是18 g/mol,1 mol H2O 的质量是18 g,故A错误;
B.1molCH4 的质量是16 g,CH4 的摩尔质量是16 g/mol,故B错误;
C.标准状况下,1 mol 任何气体物质的体积均为22.4 L,但对于液态、固体则不是,故C错误;
D.氧气物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,其质量为0.5mol×32g/mol=16g,故D正确,
故选:D.
点评 本题考查物质的量有关计算、气体摩尔体积、摩尔质量,比较基础,注意气体摩尔体积的使用条件与对象,理解温度、压强对气体摩尔体积的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ⅠFe(s)+CO2(g)=FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ⅡFe(s)+H2O(g)=FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ⅢCO(g)+H2O(g)=CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
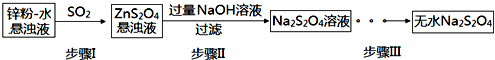
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/h | 0 | 1 | ||
| pH | 4.7 | 4.6 | 4.56 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放置在空气中生成淡黄色的Na2O2固体 | |
| B. | Fe在O2中燃烧产物可用于制红色涂料 | |
| C. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| D. | FeCl2溶液中滴加氨水至过量,加热蒸干溶液,最后灼烧可得到Fe2O3固体 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
某反应的△H=+100kJ·mol-1,以下有关该反应的叙述正确是_________
①正反应活化能小于100kJ·mol-1
②逆反应活化能一定小于100kJ·mol-1
③正反应活化能不小于100kJ·mol-1
④正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com