
为测定碳酸钠的质量分数(设含杂质碳酸氢钠),某学生设计了如下两个实验方案,请回答每个方案中的问题。
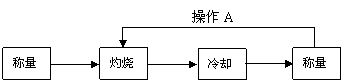 [方案Ⅰ] 重量法:
[方案Ⅰ] 重量法:
|
|||
|
(1)称量所需要的仪器是 。
(2)样品放在 仪器中灼烧。
a.蒸发皿 b.烧杯 c.坩埚
(3)实验中操作A的名称为 。
(4)如果灼烧后的样品放在空气中冷却,会造成实验结果 (填“偏大”、“偏小”或“不变”)。
(5)样品碳酸钠的质量分数 。已知该样品碳酸钠的质量分数为0.913,则本次实验的相对误差为 。
[方案II] 滴定法:①称取样品 M g;②用amol/L 过量盐酸VmL在烧杯中溶解样品,并加水稀释配成100mL溶液;③取溶解后的溶液20.00mL,用bmol/L NaOH溶液滴定,恰好用去V,mL;④重复③的操作2~3次。
(6)配成上述溶液所需要的容器的名称是 。滴定中还需要的试剂是 。
(7)操作④的目的是 。
(8)滴定测得的过量盐酸中含HCl的总物质的量的表达式为 。
(9)下列操作会使过量盐酸中含HCl测定值偏小的是 。
a.盛放氢氧化钠的滴定管只用蒸馏水洗涤
b.滴定过程中有液体溅出
c.滴定中用蒸馏水冲洗锥形瓶内壁
(10)综上所述,你认为2个方案中,较好的方案是 。
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
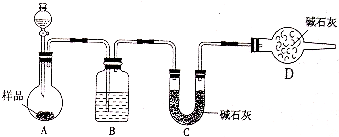
 某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.
某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:
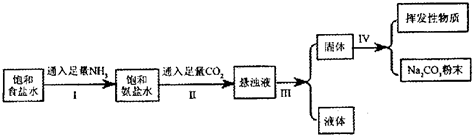
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
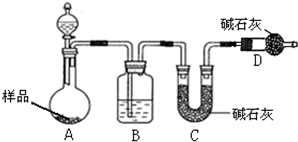 为测定碳酸钠与碳酸氢钠混合物样品中碳酸钠的质量分数,设计如下实验方案:
为测定碳酸钠与碳酸氢钠混合物样品中碳酸钠的质量分数,设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:
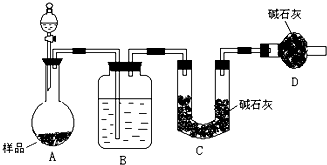
一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
I.甲同学的方案如图所示:
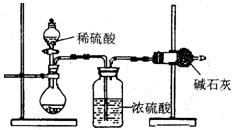
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行 次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是 (填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,
称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是 。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是 ;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com