
下列过程中,不涉及氧化还原反应的是
A.浓硫酸加入蔗糖固体中 B.金属钠放置在空气中变质
C.SO2使品红溶液褪色 D.NO2形成酸雨
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


| a2b2-5a1b1 |
| 2b0 |
| a2b2-5a1b1 |
| 2b0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a2b2-5a1b1 |
| 2b0 |
| a2b2-5a1b1 |
| 2b0 |
查看答案和解析>>
科目:高中化学 来源:2013届天津市蓟县一中高三第一次月考化学试卷(带解析) 题型:计算题
抗击“非典”期间,过氧乙酸是广为使用的消毒剂,它可由H2O2和、冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
① MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═ Mn2+ +
Mn2+ + O2 +
O2 +  H2O
H2O
② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
③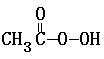 + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
+ 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
④I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式: MnO4- +
MnO4- + H2O2 +
H2O2 + H+ ═
H+ ═  Mn2++
Mn2++  O2 +
O2 +  H2O
H2O
(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有
准确称量,是否影响测定结果 (填是或否)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省郑州市高三上学期期中考试化学试卷 题型:实验题
(共8分)抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③CH3COOOH+2 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
④I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(2)用双线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0 L待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol· 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com