
| A. | 常温下,在0.10mol•L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大 | |
| B. | 常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7 | |
| C. | 已知草酸氢钾溶液呈酸性,则在0.1 mol•L-1KHC2O4溶液中c(C2O42-)>c(K+)>c(H2C2O4) | |
| D. | pH=3的0.1 mol•L-1HA溶液与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) |
分析 A.向醋酸溶液中加入醋酸钠固体抑制醋酸电离;
B.根据电荷守恒判断;
C.HC2O4-部分电离,c(K+)>c(C2O42-);
D.根据电荷守恒和物料守恒分析解答.
解答 解:A.向醋酸溶液中加入醋酸钠固体抑制醋酸电离,溶液中氢离子浓度减小,溶液的pH增大,故A正确;
B.溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+c(Cl-),所以c(H+)=c(OH-),所以溶液呈中性,故B正确;
C.HC2O4-部分电离,c(K+)>c(C2O42-),故C错误;
D.根据溶液的电中性可知溶液中存在c(H+)+c(Na+)=c(OH-)+c(A-),根据物料守恒2c(Na+)=c(A-)+c(HA),两者综合得到2c(H+)+c(HA)=c(A-)+2c(OH-),故D正确;
故选C.
点评 本题考查了弱电解质的电离、pH的计算等知识点,侧重于学生的分析能力的考查,为高频考点,注意把握物料守恒和电荷守恒的运用,难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| 实验 | 检验方法 | |
| A | 向沸水中滴加饱和FeCl3溶液,制备胶体 | 用可见光束照射 |
| B | 确认铜与浓硫酸反应生成CuSO4 | 将反应后溶液转入盛有水的烧杯中 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与1molCl2反应时转移的电子数为3NA | |
| B. | 2g H218O与D216O的混合物中所含中子、电子数目均为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO4溶液10L,含H+的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
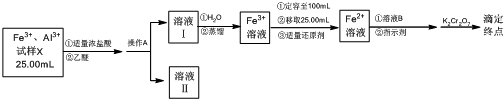
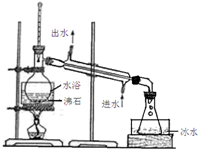
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
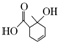
| A. | 能和碳酸钠溶液反应的官能团有2种 | |
| B. | 1 mol该有机物最多能与2 mol H2发生加成 | |
| C. | 与 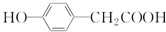 互为同分异构体 互为同分异构体 | |
| D. | 既可以发生取代反应又可以发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
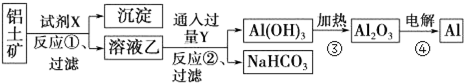
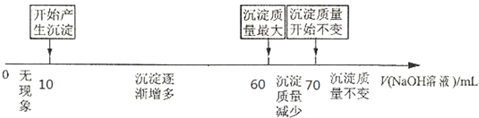
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2 | |
| B. | 将lmol Cl2通人水中,HClO、Cl一、ClO-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4 NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭吸附新装修居室里的有害气体 | |
| B. | 用K2Cr2O7检查司机是否酒后驾车 | |
| C. | 用盐酸清洗陶瓷面盆上的铁锈迹 | |
| D. | 用石灰水吸收燃煤烟气中的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com