
将1 mol CH4与Cl2发生取代反应,待反应完全后,测得四种有机物的物质的量相等,则消耗的Cl2的物质的量为( )
A.0.5 mol B.2 mol
C.2.5 mol D.4 mol
科目:高中化学 来源: 题型:
甲、乙两种物质的溶解度曲线如右图所示。下列说法中正确的是
A. t1℃时甲和乙的饱和溶液,升温到t2℃时仍是饱和溶液
B. 甲和乙的溶解度相同
C. t1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液
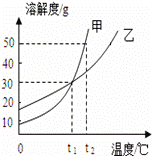 D. t2℃时,在100g水中加入60g甲,形成不饱和溶液
D. t2℃时,在100g水中加入60g甲,形成不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
(1)C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
(2)C70分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数 + 面数-棱边数= 2。
根据以上所述确定:
(1)C70分子中所含的单键数和双键数;
(2)C70分子中的五边形和六边形各有多少个?
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是核电荷数1~18元素的原子,具有相同的电子层数,而且B的核电荷数比A大2,C的质子数比B多4,1 mol A与水反应生成1 g H2,这时A转化成Ne的电子层结构。
(1)A的元素名称为________。
(2)B离子的结构示意图为_______________________________。
(3)C元素原子的结构示意图为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是________(填名称,下同),Y是________,Z是________。
(2)由Y和Z组成,且Y和Z质量比为720的化合物的化学式(分子式)是________。
(3)分别由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是________和________。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为423,该盐的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
A.②④ B.②③
C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
I.近年来全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量影响严重,这是目前重要的研究课题 。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
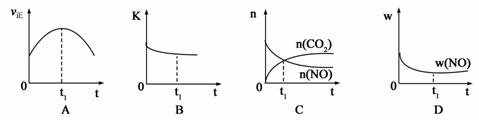
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
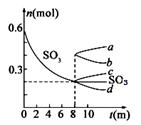 Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,右图表
示SO3 物质的量随时间的变化曲线。
① 达到平衡时,用SO2表示的化学反应速率为 。
② 平衡时,SO3的转化率为 (保留小数点后一位);
T1℃时,反应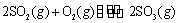 的
的
平衡常数为 ; 其他条件不变,在8min时压缩容器体积至0.5L,
则n(SO3)的变化曲线为 (填字母)。
③右表为不同温度(T)下,反应2SO2(g) + O2(g)  2SO3(g) (△H<0)
2SO3(g) (△H<0)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
的化学平衡常数(K),由此推知,温度最低
的是 (填“T1”、“T2” 或 “T3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com