
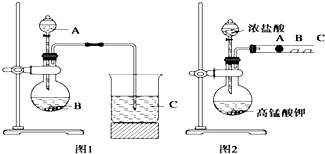
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳与硅的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红色试纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.根据图1回答:分析 根据图1,可知,应该运用弱酸制强酸或较强酸制较弱酸的实验原理,即用硝酸制取二氧化碳,用二氧化碳与硅酸钠反应制硅酸;
根据图2,可知,应该运用非金属单质之间的置换反应来判断非金属元素的强弱.
解答 解:(1)要比较碳和硅两种元素的非金属强弱,可以通过其最高价氧化物对应水合物的酸性强弱来判断,即可用较强酸制备较弱酸,因此可考虑把CO2气体通入Na2SiO3溶液,看是否有硅酸沉淀生成.观察图1,B为颗粒状固体,则可判断B为CaCO3,应用硝酸(不用硫酸,因为硫酸无法与碳酸钙反应制取二氧化碳)与碳酸钙反应制取CO2.则A是硝酸,B是碳酸钙,C是硅酸钠溶液.
故答案为:硝酸;碳酸钙;硅酸钠溶液;
(2)烧瓶中应是碳酸钙与稀硝酸反应,因为碳酸钙难溶于水,要写分子式,硝酸是强酸,要写成离子,因此烧瓶中反应的离子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.烧
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)由图2,根据题意,浓盐酸与高锰酸钾反应会生成氯气,然后氯气经过B处会与KI反应生成I2,由此可知,验证卤族元素性质的递变规律的实验原理是:强氧化剂生成弱氧化剂 或活泼的非金属单质置换出较不活泼的非金属单质,
故答案为:强氧化剂生成弱氧化剂或活泼的非金属单质置换不活泼的非金属单质;
(4)氯气在B处与KI反应生成单质碘,碘单质与淀粉作用会变成蓝色,即B处的实验现象是:湿润的淀粉KI试纸变蓝,
故答案为:湿润的淀粉KI试纸变蓝;
(5)B处氯气与KI反应的化学方程式是:Cl2+2KI═2Cl-+I2,其离子方程式是:2I-+Cl2?I2+2Cl-.
故答案为:2I-+Cl2?I2+2Cl-;
(6)B中硝酸与碳酸钙反应,由于反应中硝酸具有挥发性,可能是挥发出的硝酸溶于水与硅酸钠反应生成硅酸沉淀,所以会对二氧化碳与硅酸钠的反应产生干扰;
故答案为:反应中硝酸具有挥发性,可能是挥发出的硝酸溶于水与硅酸钠反应生成硅酸沉淀.
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,有一定的难度.


科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有氢气生成的溶液中:Mg2+,Cl-,NO3-,K+ | |
| B. | 常温下,c(H+)=0.1 mol/L的溶液中:Na+,AlO2-、S2-、SO32- | |
| C. | 含有0.1 mol/LHCO3-的溶液:Na+,Fe3+,NO3-,SCN- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+,K+,CO32-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子量的递增,量变引起质变 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正价数一定等于其原子核外最外层电子数 | |
| B. | 原子序数为79的元素在第六周期第IB族 | |
| C. | 碱金属单质的熔、沸点从上到下递减 | |
| D. | 同周期从左到右,元素的金属性递减,非金属性递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b+2}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
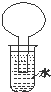 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的CH4和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
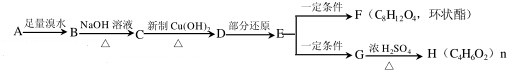
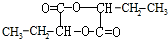 ,H
,H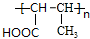 .
.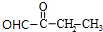 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$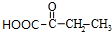 +Cu2O+2H2O,E→F2
+Cu2O+2H2O,E→F2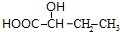 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com