
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 下列说法正确的是( ) 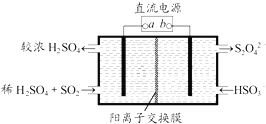
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO3﹣+2H++e﹣═S2O42﹣+2H2O
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
【答案】C
【解析】解:A、二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极与电源正极a相连,故A错误; B、阴极的电极反应式为:2HSO3﹣+2H++2e﹣═S2O42﹣+2H2O,故B错误;
C、阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+ , 故C正确;
D、阳离子交换膜只允许阳离子通过,电解时,阳离子移向阴极,所以H+由阳极室通过阳离子交换膜到阴极室,故D错误;
故选C.
根据电解池中阳极发生氧化反应,与电源正极相连的为阳极可以判断①图中a极要连接电源的正极;依据电极原理和反应过程中的离子变化写出电极反应;
依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2﹣2e﹣+2H2O═SO42﹣+4H+ , 阳极与电源的正极a相连,b为电源负极.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】①丁烷 ②2﹣甲基丙烷 ③正戊烷 ④2﹣甲基丁烷 ⑤2,2﹣二甲基丙烷等物质的沸点排列顺序正确的是( )
A.①>②>③>④>⑤
B.③>④>⑤>①>②
C.⑤>④>③>②>①
D.②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol;
O2(g)═H2O(l)△H=﹣285.8kJ/mol;
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJ/mol;
H2O(l)═H2O(g)△H=+44.0kJ/mol.
(1)写出丙烷燃烧生成CO2和气态水的热化学方程式:
(2)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kj,则混合气体中H2和C3H8的体积比为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用量筒量取 5mL 蒸馏水
B.用分液漏斗分离乙醇和水
C.用托盘天平称量 NaCl 固体 5.8g
D.用 pH 试纸测氯水的 pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A. 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B. 加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C. 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的NH4+
D. 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl﹣、SO42﹣、Br﹣、CO32﹣HCO3﹣等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
(1)火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示: 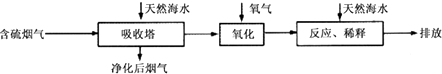
(i)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因 .
(ii)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(iii)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).
(iv)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 , 所得溶液中c(H+)﹣c(OH﹣)=(填字母编号).
A.c(SO32﹣)﹣c(H2SO3) B.c(SO32﹣)+c(NH3 . H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+) D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10﹣17 | 5.6×10﹣8 | 6.3×10﹣50 | 7.1×10﹣9 | 1.2×10﹣15 | 3.4×10﹣28 |
(i)你认为往废水中投入(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(ii)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= .
(iii)如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1gmL﹣1).若环境要求排放标准为c(Ag+)低于1.0×10﹣8mol/L,问该工厂处理后的废水中c(Ag+)= . (已知KSP(AgCl)=1.8×10﹣10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“﹣”.关于标有“+”的接线柱,下列说法中正确的是( )
A.充电时作阳极,放电时作负极
B.充电时作阳极,放电时作正极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中的乙烯以得到纯净乙烷的方法是( )
A. 通过足量的NaOH(aq)
B. 通过足量的溴水
C. 在Ni催化、加热条件下通入H2
D. 通过足量的酸性KMnO4(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com