
.下列说法正确的是( )
A.用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐
B.用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml
C.将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15%
D.浓硝酸必须保存在棕色玻璃瓶中;钠必须保存在煤油中
【知识点】仪器的使用,药品的保存以及溶液混合规律 J1
【答案解析】D 解析:A、使用量筒量体积和使用天平测量质量都只能记录到小数点后1位,故A错误;B、不能用pH试纸测氯水的pH,故B错误;C、将质量分数为5%和25%的氨水等质量混合后,所得溶液中溶质的质量分数等于15%,由于等质量时25%的氨水体积大,需再加入一些5%的氨水才能是等体积,所以将质量分数为5%和25%的氨水等体积混合,溶质的质量分数小于15%,故C错误;D、浓硝酸光照易分解,须保存在棕色玻璃瓶中;钠能与水、氧气反应必须保存在煤油中以隔绝空气,故D正确。
故答案选D
【思路点拨】本题考查了仪器的使用,药品的保存以及溶液混合规律,难点是C,如果将质量分数为5%和25%的硫酸等体积混合后,所得溶液中溶质的质量分数大于15%。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
(1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NOONH4(s)  2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度( | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度( | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
氨基甲酸铵分解反应的焓变 H__________0(填“>”、“<”或“=”)
H__________0(填“>”、“<”或“=”)
可以判断该分解反应已经达到化学平衡的是____________.(填字母)
A. 2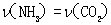
B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
根据表中数据,计算25.0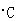 时的分解平衡常数为____________.
时的分解平衡常数为____________.
(2) 25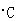 时,NH3·H2O电离常数Kb=1.8
时,NH3·H2O电离常数Kb=1.8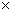 10-5,Mg(OH)2的溶度积常数Ksp=1.8
10-5,Mg(OH)2的溶度积常数Ksp=1.8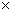 10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3
10-11,计算0.5mol/L氨水的pH约为__________.(已知lg3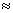 0.5)
0.5)
在某氯化镁溶液中加入一定量的某浓度的氨水后,测得混合液PH=11,则此温度下残留在溶液中的c(Mg2+)=_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图示装置进行有关实验,其中能达到实验目的或得出正确结论的是
| 选项 | ① | ② | ③ | ④ | 实验目的或结论 | 装置 |
| A | 浓盐酸 | MnO2 | 干燥红色布条 | NaOH溶液 | 干燥布条不褪色 |
|
| B | 稀硝酸 | 铜粉 | 空气 | NaOH溶液 | 制备收集NO | |
| C | 浓硫酸 | 木炭 | 品红溶液 | NaOH溶液 | 浓硫酸具有氧化性 | |
| D | 浓氨水 | NaOH固体 | 空气 | 水 | 制备收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学欲分别完成“钠与氯气反应”的实验.
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I).该方案的不足之处有 钠预先在空气中加热,会生成氧化物,影响钠在氯气中燃烧;实验过程中会产生少量污染 (至少答出两点).
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;待装置中出现 现象后,点燃酒精灯.
(2)点燃酒精灯后,玻璃管中出现的现象是 钠熔化并燃烧,产生黄色火焰,有白烟(至少答出两点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积.
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是
碱式(填“酸式”或“碱式”)滴定管.
②为提高测量的准确性,图Ⅲ装置中的液体可用 饱和NaCl溶液;收集完气体并冷却至室温后读数,读数前应进行的操作是 .
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积 (填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
【知识点】化学实验
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质.
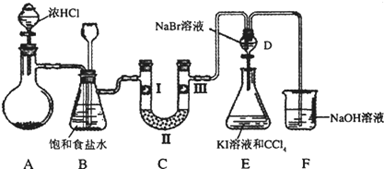
(1)若A装置中固体药品为MnO2,其化学方程式为
若A装置中固体药品为KClO3,则反应中每生成1molCl2时转移电子的物质的量为 mol.
(2)装置B的作用:
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 .
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能 。
(5)请用化学方程式说明装置F的作用 。
(6)甲同学提出,装置F中的试剂可改用过量的Na2SO3溶液,乙同学认真思考后认为此法不可行.请用离子方程式解释乙认为不可行的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,不能达到实验目的的是 ( )
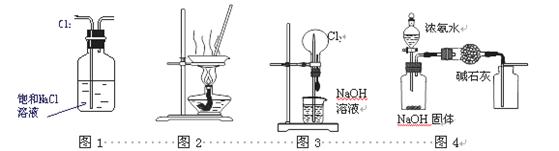
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸发KCl溶液制备无水KCl
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取干燥纯净的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O===O | P===O |
| 键能/kJ·mol-1 | 172 | 335 | 498 | X |
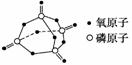
已知白磷的燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=____________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为____________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应热ΔH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用如图所示装置进行化学反应X+2Y====
2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升。关于该反应的叙述正确的是( )
①该反应为放热反应
②生成物的总能量比反应物的总能量高
③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来
A.①②③ B.①③
C.①② D.②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com