
| A. | C3H8O | B. | C2H6O | C. | C2H4O2 | D. | C4H10 |
分析 根据浓硫酸和氢氧化钠溶液增重的质量可计算有机物生成的水和二氧化碳的物质的量,根据C元素、H元素守恒和O元素守恒可计算有机物中C、H、O元素的物质的量,进而计算各元素的物质的量之比,最终可计算有机物的分子式.
解答 解:浓硫酸增重可知水的质量为7.2g,则水的物质的量为:n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=0.8mol,m(H)=0.8g;
氢氧化钠溶液增重13.2g,则二氧化碳质量为:13.2g,n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,m(C)=3.6g,m(C)+m(H)=4.4g,
有机物的质量为6g,所以该有机物中氧的质量为:6g-4.4g=1.6g,含有氧原子的物质的量为:n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
所以:n(C):n(H):n(O)=0.3mol:0.8mol:0.1mol=3:8:1,
即该有机物的实验式为:C3H8O,由于C3H8O中碳原子已经饱和,
所以其分子式也为C3H8O,
故选A.
点评 本题考查了分子式的计算,题目难度中等,计算时含有氧原子数时可根据质量守恒来确定和计算,需要注意的是若实验式中碳原子已经饱和,则分子式和实验式相同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
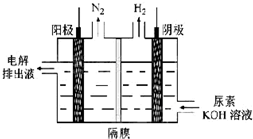 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
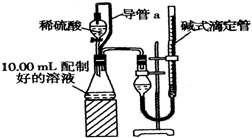 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 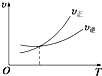 | B. | 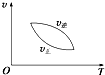 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加少量盐酸时,生成的气体可能含有CO2 | |
| B. | 原溶液中一定含有NO3-、Fe2+,一定不含Fe3+、H+、CO32- | |
| C. | 原溶液中一定含有的离子为NO3-,可能含有Fe2+、I- | |
| D. | 若原溶液中逐滴加入NaOH溶液,沉淀的量先增加后减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中一定有新物质生成,同时也一定有能量的变化 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中不一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 化学键是物质中原子间强烈的相互作用 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com