
| 选项 | X溶液 | 固体Y | Z溶液 | 现象 |  |
| A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
| B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
| C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
| D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.亚硫酸氢钠与稀硫酸反应生成二氧化硫气体,二氧化硫具有漂白性,能够使品红溶液褪色;
B.浓氨水与氧化钙反应生成氨气,氨气与紫色石蕊试液变蓝;
C.盐酸与石灰石反应生成二氧化碳气体,二氧化碳与硅酸钠溶液反应生成硅酸沉淀;
D.双氧水在二氧化锰作催化剂条件下分解生成氧气,氧气能够氧化硫化氢生成S单质.
解答 解:A.稀硫酸与亚硫酸氢钠溶液反应生成SO2,SO2具有漂白性,能够漂白品红溶液,故A正确;
B.CaO与水反应生成氢氧化钙,该反应为放热反应,则将浓氨水滴入CaO上会放出氨气,氨气使紫色石蕊试液变蓝,不会变红,故B错误;
C.石灰石为碳酸钙,碳酸钙与盐酸反应为:CaCO3+2HCl=CaCl2+H2O+CO2↑,生成的CO2与硅酸钠反应生成硅酸沉淀,则B中会出现白色沉淀,故C正确;
D.双氧水是过氧化氢溶液的俗称,过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,氧气能够将硫化氢氧化成S单质,从而使B中出现浑浊现象,故D正确;
故选B.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确常见元素单质及其化合物性质为解答关键,注意掌握性质方案设计与评价的原则,试题培养了学生的化学实验能力.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
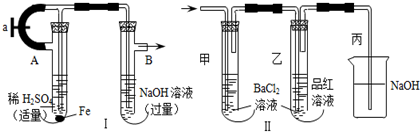
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
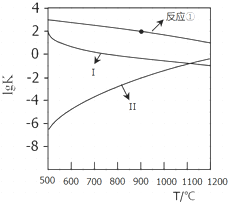 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.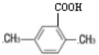 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为SiO2 | B. | 熔化时共价键断裂 | ||
| C. | 属于酸性氧化物 | D. | 1mol SiO2中含有4 mol Si-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
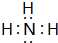 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)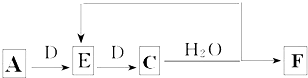
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
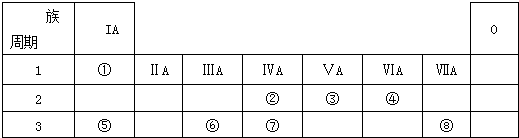
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的分子 | |
| C. | 1molO2中含有1.204×1024个氧原子,在标准状况下占有体积22.4L | |
| D. | 由0.2g H2和8.8g CO2、5.6g CO组成混合气体,其密度是相同状况下O2密度的0.913倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com