
科目:高中化学 来源: 题型:
| A、甲烷,乙烯 |
| B、乙烷,乙烯 |
| C、甲烷,丙烯 |
| D、甲烷,丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
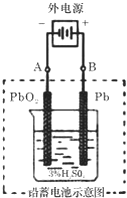
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入NaOH溶液后,溶液一定满足:c(H+)+c(Na+)═c(OH-)+c(C1-)+c(CH3COO-) |
| B、加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计):c(CH3COO-)+c(CH3COOH)=0.05 mol/L |
| C、加入15 mLNaOH溶液时,呈酸性,溶液满足:c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D、加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为:H+(aq)+OH-(aq)═H2O(1)△H=一57.3 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 棉球变白, 微热后又恢复红色 | 解释: 结论:该气体具有漂白性. | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 化学方程式: 结论:该气体具有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com