
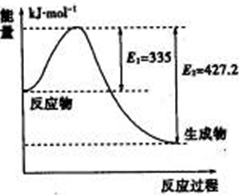
 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| A、0.10mol?L-1NH4Cl溶液中:c(Cl-)>c(H+)>c(NH+)>c(OH-) |
| B、0.20mol?L-1Na2CO3溶液和0.20mol?L-1NaHCO3溶液等体积混合后:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,C(CH3COO-)>C(Na+)>C(H+)>C(OH-) |
| D、0.10mol?L-1醋酸钡溶液中:c(Ba2+)=c(CH3COO-)+c(CH3COOH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中氧化剂与还原剂物质的量之比为1:2 |
| B、要使8.7g MnO2完全反应,需投入含0.4molHCl的浓盐酸 |
| C、每生成标准状况下2.24L Cl2,就有7.3gHCl被氧化 |
| D、若有0.4molHCl被氧化,反应中转移的电子数为0.4×6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| B、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| C、铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ |
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化):
利用图所示装置收集以下8种气体(图中烧瓶的位置不得变化):查看答案和解析>>
科目:高中化学 来源: 题型:
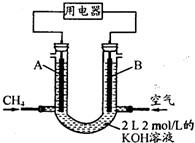 海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com