
在0 ℃、101 kPa时进行下列实验:甲、乙、丙各取30.0 mL同浓度的盐酸,加入同一镁铝合金粉末产生气体,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
(1)盐酸的物质的量浓度为____________。
(2)合金中镁的质量分数为____________,铝的质量分数为____________。
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:022
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
0~4min时,容器气体压强为101 KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
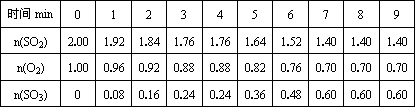
回答下列问题:
①________时,反应处于平衡状态.
②第5 min时,从速率和转化率两个方面分析,改变的外界条件是________;平衡向________方向移动.
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的变化曲线如图.
的值,与SO2平衡时的体积百分含量的变化曲线如图.
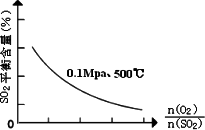
在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的大致变化曲线.
的值,与SO2平衡时的体积百分含量的大致变化曲线.
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol·L―1的H2C2O4溶液滴加0.01 mol·L―1KOH溶液V(mL),回答下列问题.
①当V<10 mL时,反应的离子方程式为________________.
②当V=10 mL时,溶液中HC2O4―、C2O42―、H2C2O4、H+的浓度从大到小的顺序为________________________.
③当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42―)+c(HC2O4―);当V=b mL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42―)+c(HC2O4―)+c(H2C2O4);则a________b(填“<”,“=”或“>”).
④当V=20 mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将________(填“变大”,“变小”,“不变”),原因是________________.
查看答案和解析>>
科目:高中化学 来源:2012届河南省焦作市高三第一次质量检测理综化学部分(带解析) 题型:填空题
(15分)中学化学常见部分元素原子结构及性质如下表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子K、L、M层电子数之比是1:4:1 |
| ③ | C | C是活泼非金属元素,其单质常温下呈气态但化学性质稳定 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料[来源:Z*xx*k.Com] |
| ⑤ | E | 通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.在101 k Pa时,1 mol C与适量![]() 反应生成1mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol
反应生成1mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol
B.在10l k Pa时,l mol![]() 完全燃烧生成液态水,放出285.8 kJ热量,
完全燃烧生成液态水,放出285.8 kJ热量,![]() 燃烧热为 ―285.8KJ/mol
燃烧热为 ―285.8KJ/mol
C.鉴定HCL和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:![]() ,若将含 0.5mol
,若将含 0.5mol![]() 的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在101 k Pa时,1 mol C与适量![]() 反应生成1mol CO时,放出110.5 kJ热
反应生成1mol CO时,放出110.5 kJ热
量,则C的燃烧热为110.5 kJ/mol
B.在10l k Pa时,l mol![]() 完全燃烧生成液态水,放出285.8 kJ热量,
完全燃烧生成液态水,放出285.8 kJ热量,![]() 燃烧热
燃烧热
为 —285.8KJ/mol
C.鉴定HCL和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起
始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:![]() ,若将含
,若将含
0.5mol![]() 的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com