
ŌŚČŻ»żĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ·“Ó¦£ŗ
A£Øg£©+2B£Øg£©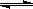 C£Øg£©+D£Øg£©£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬DµÄĪļÖŹµÄĮæn£ØD£©ŗĶŹ±¼ätµÄ¹ŲĻµČēĶ¼”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
C£Øg£©+D£Øg£©£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬DµÄĪļÖŹµÄĮæn£ØD£©ŗĶŹ±¼ätµÄ¹ŲĻµČēĶ¼”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©800”ꏱ”£0”Ŗ5minÄŚ£¬ŅŌB±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ”””””””””””””””””” ”£
£Ø2£©ÄÜÅŠ¶ĻøĆ·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ”””””””””””””””””””””” ”£
””””A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä””””””””””
B£®»ģŗĻĘųĢåÖŠc£ØA£©²»±ä
””””C£®2vÕż£ØB£©=vÄę£ØD£©”””””””” D£®c£ØA£©=c£ØC£©
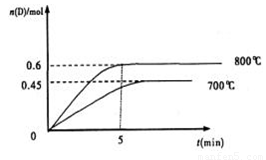
£Ø3£©Čō×ī³õ¼ÓČė1.0molAŗĶ2.2molB£¬ĄūÓĆĶ¼ÖŠŹż¾Ż¼ĘĖć800”ꏱµÄĘ½ŗā³£ŹżK=”””” ”””” £¬øĆ·“Ó¦ĪŖ”””””””””””””” ·“Ó¦£ØĢīĪüČČ»ņ·ÅČČ£©
£Ø4£©700”ꏱ£¬Ä³Ź±æĢ²āµĆĢåĻµÖŠø÷ĪļÖŹµÄĮæČēĻĀ£ŗn£ØA£©=1.1mol£¬n£ØB£©=2.6mol£¬n£ØC£©=0.9mol£¬n£ØD£©=0.9mol£¬Ōņ“ĖŹ±øĆ·“Ó¦”””””””””””””””””” ½ųŠŠ£ØĢī”°ĻņÕż·“Ó¦·½Ļņ”±”°ĻņÄę·“Ó¦·½Ļņ”±»ņ”°“¦ÓŚĘ½ŗāדĢ¬”±£©”£
£Ø1£©0.24mol”¤L”Ŗ1”¤min”Ŗ1
£Ø2£©AB£Ø2·Ö£¬Ā©Ņ»øöæŪ1·Ö£¬“ķŃ”²»µĆ·Ö£©
£Ø3£©0.9£Ømol”¤L”Ŗ1£©”Ŗ1£Øµ„Ī»æɲ»Š“£© ĪüČČ
£Ø4£©ĻņÕż·“Ó¦·½Ļņ
”¾½āĪö”æ£Ø1£©800”ꏱ”£0”Ŗ5minÄŚ£¬Éś³ÉDŹĒ0.6mol£¬ŌņĻūŗÄBŹĒ1.2mol£¬ĖłŅŌBµÄ·“Ó¦ĖŁĀŹŹĒ £½0.24mol”¤L”Ŗ1”¤min”Ŗ1”£
£½0.24mol”¤L”Ŗ1”¤min”Ŗ1”£
£Ø2£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±æÉÄę·“Ó¦ÖŠÕż·“Ó¦ĖŁĀŹŗĶÄę·“Ó¦ĖŁĀŹĻąµČŹ±£Øµ«²»ĪŖ0£©£¬ø÷ÖÖĪļÖŹµÄÅØ¶Č»ņŗ¬Įæ¾ł²»ŌŁ·¢Éś±ä»ÆµÄדĢ¬£¬ŹĒ»ÆŃ§Ę½ŗāדĢ¬,ĖłŅŌBÕżČ·”£Ę½ŗāŹ±ÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬µ«ĪļÖŹÖ®¼äµÄÅØ¶Č²»Ņ»¶ØĻąµČ»ņĀś×ćijÖÖ¹ŲĻµD²»ÕżČ·£»·“Ó¦¹ż³ĢÖŠŃ¹ĒæŹĒ±ä»ÆµÄ£¬ĖłŅŌµ±Ń¹Ēæ²»ŌŁ·¢Éś±ä»ÆŹ±£¬æÉŅŌĖµĆ÷£¬AÕżČ·£»CÖŠ·“Ó¦ĖŁĀŹµÄ·½ĻņĻą·“£¬µ«²»ÄÜĀś×ćĻąÓ¦µÄ»Æѧ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌ²»ÕżČ·£¬“š°øŃ”AB”£
£Ø3£©Ę½ŗāŹ±A”¢B”¢C”¢DµÄÅØ¶Č·Ö±šŹĒ£Ømol/L£©0.4”¢1.0”¢0.6”¢0.6£¬ĖłŅŌ·“Ó¦µÄĘ½ŗā³£ŹżŹĒ £»øł¾ŻĶ¼ĻńæÉÖŖ£¬ÉżøßĪĀ¶Č£¬DµÄŗ¬ĮæŌö¼Ó£¬ĖµĆ÷Õż·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦”£
£»øł¾ŻĶ¼ĻńæÉÖŖ£¬ÉżøßĪĀ¶Č£¬DµÄŗ¬ĮæŌö¼Ó£¬ĖµĆ÷Õż·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦”£
£Ø4£©ŌŚ700”ęĘ½ŗāŹ±A”¢B”¢C”¢DµÄÅØ¶Č·Ö±šŹĒ£Ømol/L£©0.55”¢1.3”¢0.45”¢0.45£¬ĖłŅŌ·“Ó¦µÄĘ½ŗā³£ŹżŹĒ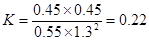 £»ÓÉÓŚ“ĖŹ±
£»ÓÉÓŚ“ĖŹ±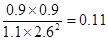 £¼0.22£¬ĖłŅŌ ĻņÕż·“Ó¦·½Ļņ½ųŠŠ”£
£¼0.22£¬ĖłŅŌ ĻņÕż·“Ó¦·½Ļņ½ųŠŠ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
| K | 2.0 | 0.27 | 0.012 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ¹ć¶«Ź”֊ɽŹŠøßČżÉĻĘŚÄ©Ķ³Ņ»æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ¼ĘĖćĢā
Ģ¼ŗĶĢ¼µÄ»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠµÄÓ¦ÓĆ·Ē³£¹ć·ŗ£¬ŌŚĢį³«½”æµÉś»īŅŃ³É³±Į÷µÄ½ńĢģ£¬”°µĶĢ¼Éś»ī”±²»ŌŁÖ»ŹĒĄķĻė£¬øüŹĒŅ»ÖÖÖµµĆĘŚ“żµÄŠĀµÄÉś»ī·½Ź½£¬ĒėŌĖÓĆ»Æѧ·“Ó¦ŌĄķµÄĻą¹ŲÖŖŹ¶ŃŠ¾æĢ¼¼°Ęä»ÆŗĻĪļµÄŠŌÖŹ”£
£Ø1£©½üÄźĄ“£¬ĪŅ¹ś“¢ĒāÄÉĆ×Ģ¼¹ÜŃŠ¾æČ”µĆÖŲ“ó½ųÕ¹£¬ÓƵē»”·ØŗĻ³ÉµÄĢ¼ÄÉĆ×¹ÜÖŠ³£°éÓŠ“óĮæĢ¼ÄÉĆ×æÅĮ££ØŌÓÖŹ£©£¬ÕāÖÖĢ¼ÄÉĆ×æÅĮ£æÉÓĆŃõ»ÆĘų»Æ·ØĢį“棬Ęä·“Ó¦»Æѧ·½³ĢŹ½ĪŖ£ŗ
____C+____K2Cr2O7 + =___CO2”ü+ ____K2SO4 + ____Cr2£ØSO4£©3+ ____H2O
ĒėĶź³É²¢ÅäĘ½ÉĻŹö»Æѧ·½³ĢŹ½”£
ĘäÖŠŃõ»Æ¼ĮŹĒ________________£¬Ńõ»Æ²śĪļŹĒ_________________
£Ø2£©¼×“¼ŹĒŅ»ÖÖŠĀŠĶČ¼ĮĻ£¬¼×“¼Č¼ĮĻµē³Ų¼“½«“ÓŹµŃéŹŅ×ßĻņ¹¤Ņµ»ÆÉś²ś”£¹¤ŅµÉĻŅ»°ćŅŌCOŗĶH2ĪŖŌĮĻŗĻ³É¼×“¼£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
CO£Øg£©+ 2H2£Øg£© CH3OH£Øg£© ”÷H1=£116 kJ”¤mol£1
CH3OH£Øg£© ”÷H1=£116 kJ”¤mol£1
¢ŁŅŃÖŖ£ŗ ”÷H2=£283 kJ”¤mol£1
”÷H2=£283 kJ”¤mol£1
 ”÷H3=£242 kJ”¤mol£1
”÷H3=£242 kJ”¤mol£1
Ōņ±ķŹ¾1molĘųĢ¬¼×“¼ĶźČ«Č¼ÉÕÉś³ÉCO 2ŗĶĖ®ÕōĘųŹ±µÄČČ»Æѧ·½³ĢŹ½ĪŖ £»
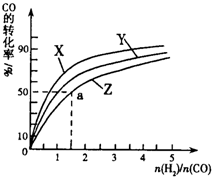
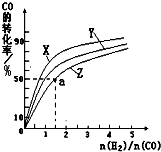
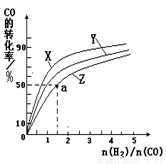
¢ŚŌŚČŻ»żĪŖ1LµÄŗćČŻČŻĘ÷ÖŠ£¬·Ö±šŃŠ¾æŌŚ230”ę”¢250”ę
270”ęČżÖÖĪĀ¶ČĻĀŗĻ³É¼×“¼µÄ¹ęĀÉ”£ĻĀĶ¼ŹĒÉĻŹöČżÖÖĪĀ¶ČĻĀ²»Ķ¬µÄH2ŗĶCOµÄĘšŹ¼×é³É±Č£ØĘšŹ¼Ź±COµÄĪļÖŹµÄĮæ¾łĪŖ1mol£©ÓėCOĘ½ŗā×Ŗ»ÆĀŹµÄ¹ŲĻµ”£
Ēė»Ų“š:
¢”£©ŌŚÉĻŹöČżÖÖĪĀ¶ČÖŠ£¬ĒśĻßZ¶ŌÓ¦µÄĪĀ¶ČŹĒ ”£
¢¢£©ĄūÓĆĶ¼ÖŠaµć¶ŌÓ¦µÄŹż¾Ż£¬¼ĘĖć³öĒśĻßZŌŚ¶ŌÓ¦ĪĀ¶ČĻĀCO(g)+ 2H2(g)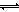 CH3OH(g)µÄĘ½ŗā³£ŹżK=
ӣ
CH3OH(g)µÄĘ½ŗā³£ŹżK=
ӣ
¢ŪŌŚÄ³ĪĀ¶ČĻĀ£¬½«Ņ»¶ØĮæµÄCOŗĶH2Ķ¶Čė10LµÄĆܱÕČŻĘ÷ÖŠ£¬5minŹ±“ļµ½Ę½ŗā£¬ø÷ĪļÖŹµÄĪļÖŹµÄÅضČ(mol•L£1)±ä»ÆČēĻĀ±ķĖłŹ¾£ŗ
|
|
0min |
5min |
10min |
|
CO |
0.1 |
|
0.05 |
|
H2 |
0.2 |
|
0.2 |
|
CH3OH |
0 |
0.04 |
0.05 |
Čō5min”«10minÖ»øıäĮĖijŅ»Ģõ¼ž£¬ĖłøıäµÄĢõ¼žŹĒ £» ĒŅøĆĢõ¼žĖłøıäµÄĮæŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com