
| A. | 纯碱、石灰石、石英、铁屑 | B. | 纯碱、石灰石、石英 | ||
| C. | 碳酸钾、石灰石、石英 | D. | 水玻璃、石灰石、石英、氧化铝 |
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、CO32-、SO42- | B. | Na+、OH-、NH4+、Cl- | ||
| C. | Fe3+、Na+、OH-、NO3- | D. | K+、Al3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
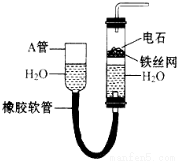 如图装置可以制取乙炔,请填空:
如图装置可以制取乙炔,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(B2)=0.8mol/( L•s) | B. | V(A2)=0.8mol/( L•min) | ||
| C. | V(C)=0.6mol/( L•s) | D. | V(D)=0.8mol/( L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3、NaOH、Mg(OH)2 | B. | NaHCO3、Na2CO3、MgCO3 | ||
| C. | NaHCO3、MgCO3、Al(OH)3 | D. | Na2CO3、MgCO3、CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素水解产物中无葡萄糖 | |
| B. | 使用的硫酸过浓,只发生了脱水反应 | |
| C. | 由于水解后混合液中含有H2SO4,所以见不到红色沉淀 | |
| D. | 加热时间不够长,所以见不到红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com