
| A、加水稀释 |
| B、加少量NaOH |
| C、加适量氢碘酸 |
| D、通入CO2 |


科目:高中化学 来源: 题型:
| 选项 | 物质成分(括号内为杂质) | 所用试剂 | 操作 |
| A | 铁屑(油污) | 纯碱溶液 | 洗涤 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 碳酸钡(硫酸钡) | 盐酸 | 溶解、过滤 |
| D | 乙醇(乙酸) | 烧碱溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (HCN)<c (CN-) |
| B、c (Na+)>c (CN-) |
| C、c (HCN)-c (CN-)=c (OH-) |
| D、c (HCN)+c (CN-)=0.1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
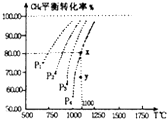 在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在一恒容的密闭窗口中充入0.1mol/LCO2,0.1mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H<0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃时该反应平衡常数为1.64 |
| D、压强为P4时,在y点:V正>V逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0表示放热反应,△H<0表示吸热反应 |
| B、热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C、1mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D、1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:
在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com