
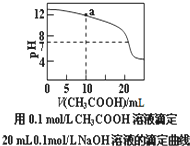
| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
分析 A.对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
B.水电离生成氢离子和氢氧根离子,所以酸或碱抑制水电离;含有弱离子的盐能发生水解生成弱电解质,则含有弱离子的盐促进水电离,分别计算水电离出的氢离子或氢氧根离子浓度比较大小;
C.用0.1mol/L的醋酸溶液滴定0.2mol/L的NaOH溶液20ml,a点是滴定消耗醋酸溶液体积10ml,此时溶液中是等浓度的溶质NaOH和CH3COONa,溶液显碱性PH=12,依据溶液中电荷守恒和物料守恒计算分析判断;
D.图中pH=7时c(OH-)=c(H+),溶液为醋酸钠和醋酸的混合溶液,根据溶液中电荷守恒分析判断离子浓度大小.
解答 解:A.在相同的条件下测得①CH3COONa ②NaHCO3 ③NaAlO2三种溶液pH相同,已知酸性:CH3COOH>HCO3->Al(OH)3,所以水解程度:NaAlO2>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaAlO2<NaHCO3<CH3COONa,c(Na+)①>②>③,故A错误;
B.25℃时①10-3mol/L的盐酸中水电离出的氢离子浓度c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=10-11mol/L,②pH=3的NH4Cl溶液中NH4++H2O?NH3•H2O+H+,水电离出的氢离子浓度c(H+)=10-3mol/L,③pH=11的氨水中,水电离出的氢离子浓度c(H+)=10-11mol/L,水的电离程度为:②>①=③,故B错误;
C.a点是滴定消耗醋酸溶液体积10ml,此时溶液中是等浓度的溶质NaOH和CH3COONa,溶液中电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液中物料守恒$\frac{1}{2}$c(Na+)=c(CH3COO-)+c(CH3COOH),代入计算得到c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故C正确;
D.溶液为醋酸钠和醋酸的混合溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),图中pH=7时c(OH-)=c(H+),则c(Na+)=c(CH3COO-),溶液中离子浓度大小为c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故D错误;
故选C.
点评 本题以盐类水解、电解质的电离、酸碱滴定为载体考查水的电离、离子浓度大小,明确水电离特点及其影响因素,溶液中电荷守恒和物料守恒是解本题关键,题目难度中等.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
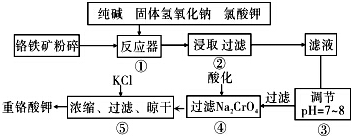
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
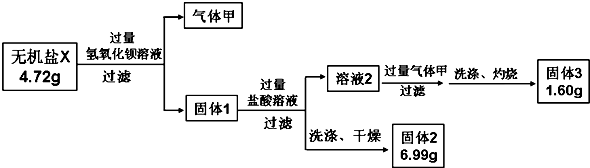
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用FeCl2、Cu2O、NaI等物质均能使题中反应发生 | |
| B. | 若用Na2S使题中反应发生则氧化过程的反应式一定为S2-+4H2O-8e-═SO42-+8H+ | |
| C. | 当收集到2.24 L(标准状况下)气体时,参与反应的HNO3为0.1 mol | |
| D. | 若将上述氧化还原反应设计成原电池,则题中反应在负极发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
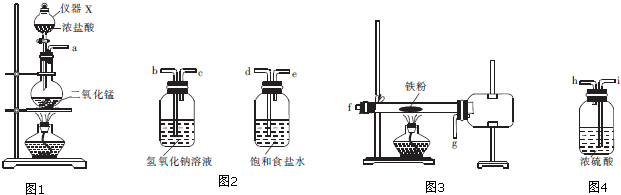
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的铁是光亮的银白色金属 | |
| B. | 铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性 | |
| C. | 铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态 | |
| D. | 纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
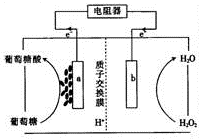 酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )
酶生物电池通常以葡萄糖作为反应原料,葡萄糖在葡萄糖氧化酶(GOX)和辅酶的作用下被氧化成葡萄糖酸(C6H1207),其工作原理如图所示.下列有关说法中正确的是( )| A. | 该电池可以在高温条件下使用 | |
| B. | H+通过交换膜从b极区移向a极区 | |
| C. | 电极a是正极 | |
| D. | 电池负极的电极反应式为C6H1206+H20-2e一═C6H1207+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com