
分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2)、少数置换反应(如C和H2O)、某些复分解(如铵盐和强碱)和碳、一氧化碳、氢气等还原金属氧化物;
(2)根据金属的活泼性判断正负极;根据电极上发生反应的类型确定电极反应式;
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+;铜为正极,电极反应为2H++2e-=H2↑;根据两极转移电子数目相等计算;
(4)反应物总能量大于生成物总能量,为放热反应,中和反应为放热反应,酸和碱反应生成水;
解答 解:(1)①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO)是分解反应,属于常见的吸热反应;
②燃烧木炭取暖是物质的燃烧,放出热量,属于常见的放热反应;
③炸药爆炸要放出热量,属于放热反应;
④酸与碱的中和反应要放热热量,属于常见的放热反应;
⑤生石灰与水作用制熟石灰,是化合反应,放出热量,属于常见的放热反应;
⑥食物因氧化而腐败要放热热量,属于放热反应;
故答案为:②③④⑤⑥;①.(11分)(1)②③④⑤⑥(1分)①(1分)
(2)根据金属的活泼性判断,铜作负极,铜失去电子变成离子进入溶液,发生氧化反应,Cu-2 e-=Cu2+;银作正极,银离子得电子生成银单质,发生还原反应,2Ag++2 e-=2Ag;故答案为:Cu;Cu-2e-=Cu2+;
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,
锌为负极,电极反应为:Zn-2e-=Zn2+,
铜为正极,电极反应为2H++2e-=H2↑,
锌片的质量减少了3.25克,则物质的量为$\frac{3.25g}{65g/mol}$=0.05mol,
转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,
则:V(H2)=0.05mol×22.4L/mol=1.12L,
故答案为:1.12L;0.1;
(4)设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为放热反应,放热反应可以看成储存在物质内部的能量转化为热能等释放出来;中和反应都是放热反应,反应的实质为H++OH-═H2O,
故答案为:放;储存在物质内部的能量转化为热能等释放出来;放;酸电离出的H+与碱电离出的OH-结合成弱电解质水:H++OH-═H2O;
点评 本题考查了放热反应与吸热反应的判断,原电池原理及其计算,以及中和反应的实质,题目难度不大,抓住基础即可解答.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
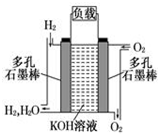 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回查看答案和解析>>
科目:高中化学 来源: 题型:解答题
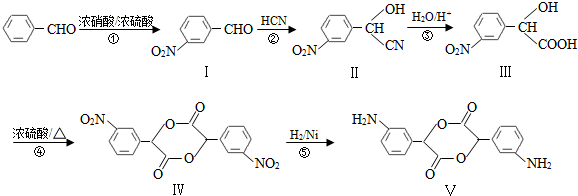
 ,和
,和 .
.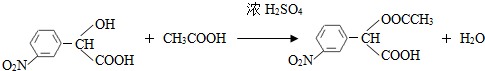 (要求写出反应条件),
(要求写出反应条件),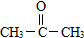 )代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为
)代替化合物 I发生反应②可以得到化合物Ⅵ,化合物Ⅵ的结构简式为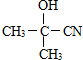 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、羊毛、病毒等主要成分都是蛋白质 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水,也不溶解 | |
| C. | 重金属盐能使蛋白质凝结 | |
| D. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
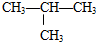 ⑤
⑤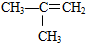
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
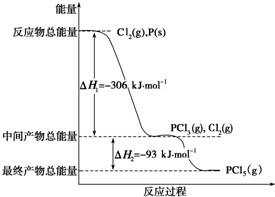 已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
已知红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com