
(1)二氧化硫的催化氧化的过程如图所示:
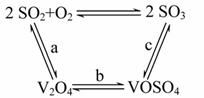
其中a、c二步的化学方程式可表示为____________
SO2+V2O5 SO3+V2O4
SO3+V2O4
4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
该反应的催化剂是__________(写化学式)。
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关 系如图所示:
系如图所示:
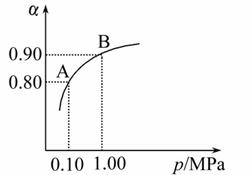
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。
2SO2+O2 在550 ℃时的平衡常数K=_________。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是_____________。
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2.0 mol SO2和1.0 mol O2
(4)维持温度不变条件下使之发生如下反应:
2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:

试填写下列空格:
A容器达到平衡时所需的时间比B容器___________(填“短”或“长”);平衡时A容器中SO2的转化率 比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
(1)催化剂的特点:参与反应,在反应前后质量和化学性质不改变。
(2)0.10 MPa时,SO2的平衡转化率为0.80,根据三段式法,即可求出平衡常数。
(3)选C。二氧化硫转化为三氧化硫的反应放热,温度升高,平衡逆向移动,n(SO3)/n(SO2)减小;充入He(g),平衡不会移动,n(SO3)/n(SO2)不变;再充入2.0 mol SO2和1.0 mol O2,相当于反应体系压强增大,平衡正向移动,n(SO3)/n(SO2)变大。
(4)反应达到平衡时,A的容积比B小,相当于压强大,反应速率快,达平衡时间短,平衡正向移动,SO2的转化率大,平衡时再充入等物质的量的原反应气体,A中反应物的转化率不变,SO3的体积分数不变,B中反应物的转化率增大,SO3的体积分数增大。
答案:(1)V2O5 (2)2.5×10-3(0.002 5) (3)C
(4)短 大 不变 增大


科目:高中化学 来源: 题型:
下列对化学反应热问题的说法正确的是( )
A.放热反应发生时不必加热
B.化学反应一定有能量变化
C.一般地说,吸热反应加热后才能发生
D.化学反应的热效应数值与参加反应的物质的多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁 锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
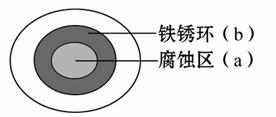
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发 生的电极反应为O2+2H2O+4e-====4OH-
生的电极反应为O2+2H2O+4e-====4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-====Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,一定条件下,某密闭容器中的可逆反应R(s)+X(g) Y(g)+Z(g)ΔH>0,达到平衡态Ⅰ后,在t1时刻改变影响平衡的一个条件,平衡发生移动,达到平
Y(g)+Z(g)ΔH>0,达到平衡态Ⅰ后,在t1时刻改变影响平衡的一个条件,平衡发生移动,达到平 衡态Ⅱ。则t1时刻的条件改变可能是( )
衡态Ⅱ。则t1时刻的条件改变可能是( )
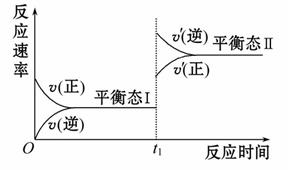
A.升高温度 B.减小体积
C.增大Y的浓度 D.加入一定量的R
查看答案和解析>>
科目:高中化学 来源: 题型:
温度为T时,向2.0 L 恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)====PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
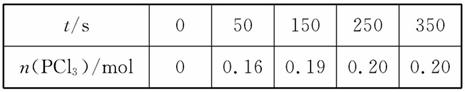
下列说法正确的是( )
A.反应在前50 s的平均速率
v(PCl3)=0.003 2 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol  PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
在加入铝粉能产生H2的溶液中,下列各组离子可能大量共存的是( )
A.NH4+ NO3- CO32- Na+
B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Mg2+ K+ Cl-
D.NO3- K+ [Al(OH)4]- OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的[OH-]的数据分别为甲:1.0×10-7 mol· L-1;乙:1.0×
L-1;乙:1.0×
10-6 mol·L-1;丙:1.0×10-2 mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为可能正确的数据是( )
A.甲、乙 B.乙、丙 C.丙、丁 D.乙、丁
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,原子序数依次增大。其中X、Z同主族,Y、Z同周期,Y原子的最外层电子数是次外层电子数的一半,X原子的最外层电子数是核外电子层数的3倍,W的最高正化合价与最低负化合价的代数之和为6。下列说法正确的是( )
A.X、Y、Z、W四种元素的简单氢化物中,W的氢化物的沸点最高
B.X、Y、Z三种元素的原子半径由大到小的顺序为Y>X>Z
C.Y、Z、W三种元素的非金属性由强到弱的顺序为W>Z>Y
D.Y、Z、W三种元素的最高价氧化物对应的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
|
| A. | 氯气溶于水:Cl2+H2O⇌2H++Cl﹣+ClO﹣ |
|
| B. | 氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
|
| C. | 氢氧化镁溶于盐酸:OH﹣+H+=H2O |
|
| D. | 碳酸钠溶液中滴入少量盐酸:CO32﹣+H+=HCO3﹣ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com