
| A. | Cu(OH)2溶于醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| C. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 明矾溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++4OH-═2AlO2-+3BaSO4↓+2H2O |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.AgNO3溶液中滴加过量氨水,先生成AgOH后被过量的氨水溶解生成络离子,得不到白色沉淀;
C.硫化银更难溶,实现了沉淀的转化;
D.氢氧化钡过量,铝离子和硫酸根离子完全反应,二者物质的量之比应该为1:2.
解答 解:A.Cu(OH)2溶于醋酸,醋酸不能拆开,正确的离子方程式为:Cu(OH)2+2CH3COOH═Cu2++2CH3COO-2H2O,故A错误;
B.氨水过量,反应生成银氨溶液,正确的反应为:Ag++2NH3•H2O═2H2O+Ag(NH3)2+,故B错误;
C.AgCl悬浊液中加入Na2S溶液,实现了沉淀的转化,反应的离子方程式为:2AgCl+S2-═Ag2S+2Cl-,故C正确;
D.明矾溶液中加入过量Ba(OH)2溶液,铝离子与硫酸根离子按照物质的量1:2反应,正确的离子方程式为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:实验题
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| B. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液中:NH4+、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.01mol•L-1的醋酸溶液中,pC(H+)=2 | |
| B. | 常温下,向0.01mol•L-1的氨水中加入等体积等浓度的盐酸,混合液的pC(H+)<7 | |
| C. | 100℃时,0.01mol•L-1的NaOH溶液中,pC(OH-)+pC(H+)=14 | |
| D. | 100℃时,CaCO3的Ksp=2.5×10-9,其饱和溶液中pC(Ca2+)+pC(CO32-)=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Al3+、Na+、SO32-、HCO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molSO2、0.5molO2、1molSO3 | B. | 4molSO2、2molO2 | ||
| C. | 4molSO3 | D. | 1molSO2、1molO2、1molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
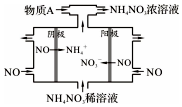 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量的澄清石灰水与碳酸氢钠溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| C. | 硫酸与Ba(OH)2溶液反应:H++OH-=H2O | |
| D. | FeCl3溶液与Fe反应:Fe3++Fe=2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com