
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如图:
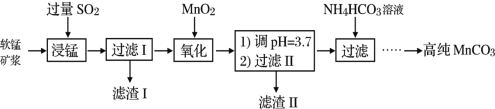
(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有___(写一条。)
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___(填离子符号)。
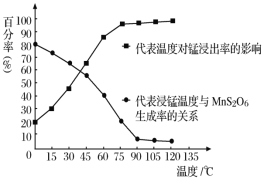
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___。
(5)写出“氧化”过程中MnO2与SO2反应的化学方程式___。
(6)滤渣Ⅱ是___(填化学式)。
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___。
【答案】搅拌或适当升高温度 2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+ Mn2+、Fe2+ 90℃ MnO2+SO2=MnSO4 Fe(OH)3 防止NH4HCO3受热分解,提高原料利用率
+4H+ Mn2+、Fe2+ 90℃ MnO2+SO2=MnSO4 Fe(OH)3 防止NH4HCO3受热分解,提高原料利用率
【解析】
由流程可知软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为SiO2,滤液含有Mn2+、Fe2+,加入MnO2氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42-,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体。
(1)可以通过搅拌或者适当升高温度,以提高“浸锰”过程中原料的浸出率。
(2)根据浸锰过程中Fe2O3与SO2反应的总化学方程式Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O和该反应的第一步反应Fe2O3+6H+=2Fe3++3H2O,两方程式相减可得到反应ⅱ的离子方程式2Fe3++SO2+2H2O=2Fe2++SO
+H2O和该反应的第一步反应Fe2O3+6H+=2Fe3++3H2O,两方程式相减可得到反应ⅱ的离子方程式2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+。
+4H+。
(3)软锰矿形成矿浆,通入足量的SO2,MnO2、Fe2O3与SO2反应生成Mn2+、Fe2+,SiO2不反应,过滤,故滤液含有Mn2+、Fe2+。
(4)由图可知,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃。
(5)综上分析,MnO2与SO2反应的化学方程式为MnO2+SO2=MnSO4。
(6)为除去滤液中的铁离子,调节pH,沉淀铁离子,将铁离子转化为氢氧化铁,最后过滤,故滤渣II为氢氧化铁。
(7)NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率。


科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)研究发现,在CO2低压合成甲醇反应(CO2+3H2 === CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
Co基态原子核外电子排布式为________,元素Mn与O中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是________。
(2)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。
回答下列问题:
①氮原子的价电子排布图为_________。
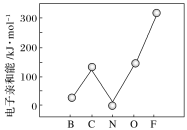
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是________;氮元素的E1呈现异常的原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
A | R | |||||||||||||||||
B | C | D | E | F | T | |||||||||||||
G | H | I | J | K | L | |||||||||||||
M | N | O | ||||||||||||||||
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X高温下反应的化学方程式______。
(2)D的简单气态氢化物的VSEPR模型的名称为______。
(3)由A、C、D形成的ACD分子中,σ键和π键个数=______。
(4)元素M的化合物(ME2L2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是______(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为______。
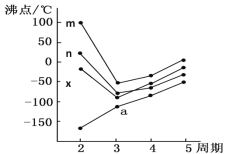
(5)如图四条折线分别表示ⅣA族、Ⅴ/span>A族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是______(填m、n、x或y)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法不正确的是______________(填字母序号)。

a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是______________。
(2)海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:__________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程的离子方程式是_______________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_______________。
②上述方式使处理后海水pH升高的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应2SO2(g)+O2(g)2SO3(g)的描述正确的是( )
A.使用催化剂,SO2的平衡转化率增大
B.增大O2浓度,平衡常数K增大
C.当2![]() 正(SO2)=
正(SO2)=![]() 逆(O2)时,反应达到平衡状态
逆(O2)时,反应达到平衡状态
D.升高温度,反应物中活化分子百分数提高,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能光伏电池电解水获得H2,工作示意图如图。下列分析不正确的是( )
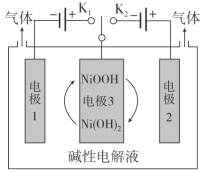
A.控制开关连接K1,电极1发生反应:2H2O+2e-=H2↑+2OH-
B.控制开关连接K2,电极3附近溶液的pH减小
C.通过控制开关连接K1或K2,可交替得到H2和O2
D.电极3的主要作用是通过NiOOH和Ni(OH)2相互转化实现电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol/L CH3 COOH溶液滴定10.00mL浓度均为0.10 mol/L NaOH和NH3·H2O的混合液,混合溶液的相对导电能力随乙酸滴入的变化曲线如下图所示。已知:Ka(CH3COOH)=1. 8×10-5,Kb( NH3·H2O) =1. 8× l0-5。下列叙述错误的是
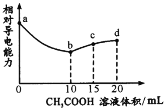
A.ab段为CH3COOH与NaOH的中和过程
B.b点水的电离程度最大
C.c点3c(Na+)=2c(CH3 COOH)+2c(CH3 COO-)
D.d点c(Na+)>c(NH![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确且为加成反应的是( )
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2+Br2→CH3-CHBr2
C.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com