
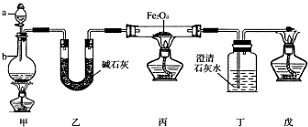
分析 由图可知,a为分液漏斗,b为圆底烧瓶,甲中发生的反应为HCOOH(甲酸)$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+H2O,乙中碱石灰可干燥CO,除去杂质,丙中发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,丁中石灰水可检验生成的二氧化碳,最后点燃处理尾气CO,以此解答(1)~(5);
(6)设总质量为1g,则铁为xg,Fe3O4为(1-x)g,根据铁的含量列方程求解.
解答 解:(1)由图可知a、b分别为分液漏斗、圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)乙装置加碱石灰其主要成分是CaO和NaOH,因此其作用是除杂即NaOH具有碱性故除去CO中的甲酸,CaO可做干燥剂故除去CO中的水蒸气,
故答案为:除去CO中的甲酸和水蒸气;
(3)由甲制得CO,发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)因为CO作还原剂化合价升高不可能生成碳单质,故答案为:从氧化还原反应原理角度分析(化合价升降),不可能产生碳单质;
(5)因为CO是有毒的可燃性气体,不纯时遇到明火会发生爆炸,实验将近完成时,防止倒吸先熄灭装置丁中酒精灯,尾气处理最后熄灭,所以熄灭装置甲、丙、戊中酒精灯的先后顺序为丁、甲、乙,
故答案为:CO在空气中遇到明火会发生爆炸;丙、甲、戊;
(6)设总质量为1g,则铁为xg,Fe3O4为(1-x)g,又氧的含量为12.5%,所以$\frac{(1-x)×64}{232}$=12.5%,解得x=0.55,所以m(Fe)=0.55g,m(Fe3O4)=0.45g,则$\frac{n(Fe)}{n(F{e}_{3}{o}_{4})}$=$\frac{\frac{\frac{0.55}{56}}{0.45}}{232}$=5:1,故答案为:5:1.
点评 本题考查了气体的制备及其工业炼铁的装置的选择等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
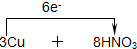 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+、Cl-、SO42-离子一定存在,CO32-离子一定不存在 | |
| B. | 原溶液中c(Fe3+)=0.4mol?L-1 | |
| C. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 | |
| D. | 取少量原溶液于试管中,先加入适量氯水,再加少量KSCN溶液,若溶液成血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氖气中含有的原子数目为NA | |
| B. | 5.85g NaCl中含有的最外层电子数目为1.6NA | |
| C. | 2mol NO和1mol O2混合,充分反应后转移的电子数目为4NA | |
| D. | 25℃时,1L 0.1mol•L-1 Na2S溶液中的阴离子数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜 | |
| B. | 绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染 | |
| C. | 茂密树林中的道道光柱,既是一种自然现象又是光学现象,与胶体知识也有关系 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
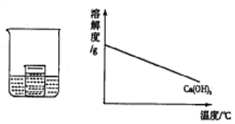 如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )
如图所示,在小烧杯中盛有饱和石灰水,大烧杯中盛有试剂X.将试剂Y加入到大烧杯X中,观察到小烧杯中的现象正确的是( )| 序号 | 试剂X | 试剂Y | 小烧杯中的现象 |
| A | 水 | 硝酸铵 | 产生白色沉淀 |
| B | 水 | 浓硫酸 | 无明显变化 |
| C | 盐酸 | 镁条 | 产生白色沉淀 |
| D | 硫酸 | 氢氧化钠 | 无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com