
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
分析 A.根据人体血液的酸碱性确定碳酸氢根离子的电离和水解程度相对大小;
B.发生酸中毒时,应用碱性物质缓解;
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-);
D.pH=7.40的血液中,HCO3-的水解程度不一定大于H2CO3的电离程度.
解答 解:A.pH=7.30的血液中,c(HCO3-):c(H2CO3)<17.8,只能说明血液中的HCO3-远大于H2CO3但并不能说明HCO3-的水解程度一定大于H2CO3的电离程度,故A错误;
B.人体血液酸中毒时,只要增加碳酸氢根即可缓解,所以可注射NaHCO3溶液当然可以缓解酸中毒,故B正确;
C.从pH随c(HCO3-):c(H2CO3)变化关系表知,pH=7.00的血液中,c(H2CO3)<c(HCO3-),故C正确;
D.人体血液pH小于7.35时碳酸会转化成碳酸氢根,使酸性降低,当人体血液pH大于7.45,碳酸氢根会转化成碳酸增大酸度,所以正常人体血液中,HCO3-的水解程度大于电离程度,故D正确;
故选A.
点评 本题考查了电解质溶液中平衡的分析应用,根据人体的酸碱平衡:CO2+H2O?H2CO3?HCO3-和pH随c(HCO3-):c(H2CO3)变化关系表的数据信息,考查了学生对给定条件平衡的分析、数据信息的分析能力,难度中等.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gO2中含有的氧分子数为NA | |
| B. | 1molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2LH2O中含有的氢原子数为NA | |
| D. | 1mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
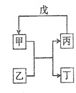 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式 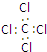 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图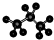 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
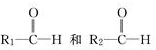 ;
;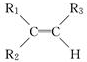 被氧化为
被氧化为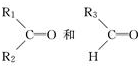 ,由此可判断分子式为C4H8的烯烃的氧化产物有( )
,由此可判断分子式为C4H8的烯烃的氧化产物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com