
【题目】A、B、C、D、E、F、G、H为八种相邻的短周期元素,其单质的沸点如图所示.
请回答:
①上述元素中,某些元素与氢元素形成的含有十个电子的阳离子中含有配位键,请写出其离子、(填化学式).
②已知D、F、G三种元素的离子具有跟E相同的电子层结构,则B、C、D三种元素的电负性由大到小的顺序为(用相关元素符号表示) . F、G、H三种元素的第一电离能由大到小的顺序为(用相关元素符号表示) .
③已知H的电负性为1.5,而氯元素的电负性为3.0,二者形成的化合物极易水解,且易升华.据此推测该化合物的化学键类型为 . 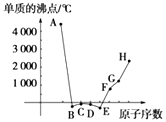
【答案】NH4+;H3O+;F>O>N;Mg>Al>Na;极性共价键
【解析】解:①上述元素中,只有N、O与氢元素形成的含有十个电子的阳离子中NH4+、H3O+中含有配位键,所以答案是:NH4+;H3O+;②同一周期元素,元素电负性随着原子序数增大而增大,所以B、C、D三种元素的电负性由大到小的顺序为F>O>N;元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以F、G、H三种元素的第一电离能由大到小的顺序为Mg>Al>Na,
所以答案是:F>O>N;Mg>Al>Na;
③H为Al元素,H的电负性为1.5,而氯元素的电负性为3.0,二者电负性差为1.5<1.7,二者形成的化合物极易水解,且易升华,则AlCl3为共价化合物,氯化铝中Al和Cl原子之间只存在极性共价键,
所以答案是:极性共价键.


科目:高中化学 来源: 题型:
【题目】增塑剂,又称塑化剂,2011年起,台湾被检测出含塑化剂食品已达961项.6月1日卫生部紧急发布公告,将邻苯二甲酸酯(也叫酞酸酯)类物质,列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.下列过程就是有机合成某增塑剂的路线:已知:烷基苯在高锰酸钾的作用下,侧链可被氧化成羧基,例如:(图1)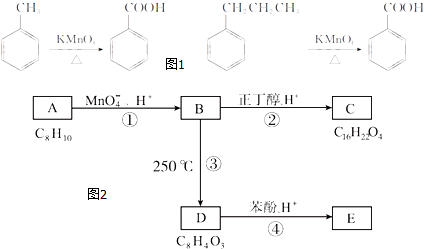
化合物A~E的转化关系如图2所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是常用增塑剂,D是有机合成的重要中间体和常用化学试剂(D也可由其他原料催化氧化得到),E是一种常用的指示剂酚酞.
(1)A的化学名称为 .
(2)B的结构简式为 .
(3)由B生成C的化学方程式为 , 该反应的类型为反应.
(4)D的结构简式为 , 在D物质的核磁共振氢谱图中,会出现组峰,峰面积之比为 .
(5)A的同分异构体中属于芳香族化合物的有种,其中一氯代产物种类最多的是(写结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl5 的分解反应如下:PCl5(g)PCl3(g)+Cl2(g)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5 , 达到平衡时,测得容器内PCl3的浓度为0.150mol/L,
(1)计算该温度下的平衡常数.
(2)计算该温度下PCl5的转化率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列类比关系正确的是( )
A.AlCl3与过量NaOH溶液反应生成AlO ![]() ,则与过量NH3?H2O也生成AlO
,则与过量NH3?H2O也生成AlO ![]()
B.Na2O2与CO2反应生成Na2CO3和O2 , 则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3 , 则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( ) 
A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO ![]() 的浓度不变
的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是足量AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答:
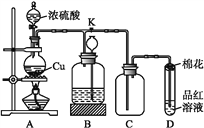
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中长颈漏斗内液面上升,广口瓶内液面下降,则B中应放置的液体是(填字母)___。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和V L 18 mol·L-1硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是__(填字母)。
A.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
③实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为_____mol;转移的电子为_____mol;反应后溶液中硫酸根离子的物质的量浓度为_________mol·L-1。(反应后溶液的体积为V L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
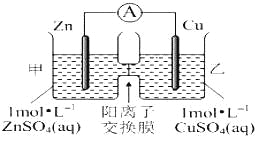
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(4)已知:
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)=2H2O(l)=﹣571.6kJmol﹣1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是( )
A.高聚物的相对分子质量一定为单体相对分子质量的整数倍
B.![]() 分子中只存在羧基、羟基两种官能
分子中只存在羧基、羟基两种官能
C.PETG的结构简式为: ![]() 合成PETG的单体有4种
合成PETG的单体有4种
D.![]() 分子中至少有16个原子共平面
分子中至少有16个原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com