
����Ŀ��ijͬѧҪ̽��ȼ�յ������Ϳ����������ĺ���������������ʵ�顣
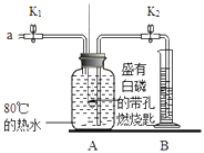
��ʵ�飩
�ټ��װ�õ������ԣ����������á�
����Aƿ�м���80����ˮ����ʢ�а��Ĵ���ȼ�ճ��ٽ�û��ˮ�У�����ƿ�������ײ�ȼ�ա�
�۴�K1��K2����a����Aƿ�й����������ƿ�е�Һ�����ȼ�ճײ�ʱ���ر�K1��K2����ʱ������ͲB��ˮ�����Ϊ200mL���۲쵽Aƿ�еİ���ȼ�ա�
��1���ԱȲ���ں͢۵������֪����ȼ��ȼ�յ�����֮һ��___������ȼ�յķ�Ӧ����ʽΪ_____��
��2����װ����ȴһ��ʱ���K2������۲쵽____��˵�����������������Լռ1/5�����ȷ����װ�����������ã�������ȼ�ճ�λ��©�������______��
���𰸡���ȼ���������Ӵ� 4P+5O2![]() 2P2O5 ����Ͳ�еģ�ˮ���뼯��ƿ����A���е����Ϊ40mL ����Ͳ��ע��ˮ����û���ܿڣ��ر�K1����K2�����漯��ƿ�������ܿ������ݲ�������ȴ���γ�һ��ˮ����������������
2P2O5 ����Ͳ�еģ�ˮ���뼯��ƿ����A���е����Ϊ40mL ����Ͳ��ע��ˮ����û���ܿڣ��ر�K1����K2�����漯��ƿ�������ܿ������ݲ�������ȴ���γ�һ��ˮ����������������
��������
��1���ԱȲ���ں͢۵�������û������ʱ�����ײ�ȼ�գ����������ʱ������ȼ�գ���֪����ȼ��ȼ�յ�����֮һ�ǿ�ȼ���������Ӵ�������ȼ�յķ�Ӧ����ʽΪ4P+5O2![]() 2P2O5��
2P2O5��
��2����װ����ȴһ��ʱ���K2������۲쵽����Ͳ�еģ�ˮ���뼯��ƿ����A���е����Ϊ40mL��˵�����������������Լռ1/5����װ�������Եļ�鷽��Ϊ����Ͳ��ע��ˮ����û���ܿڣ��ر�K1����K2�����漯��ƿ�������ܿ������ݲ�������ȴ���γ�һ��ˮ���������������á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��������������к���Cu��Au(��)��PbSO4�����ʣ�ʪ����������������ۺ����õĹ���������ͼ��ʾ��
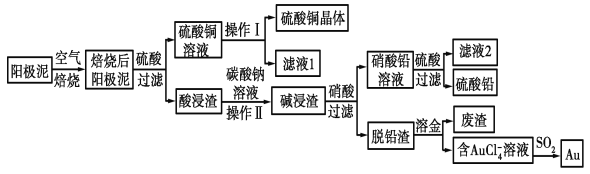
��1����⾫����ͭ����Ǧ�Ĵ�ͭʱ�����ҺӦ����________��Һ�����Һ�����ʱ�����ĵ缫��ӦʽΪ___________________________��Cu��2e��===Cu2����
��2����ɲ���������Ҫ�����У�__________________�����ˣ�ϴ�ӣ����
��3��д����SO2��ԭAuCl4-�����ӷ�Ӧ����ʽ____________________________��
��4��Ϊ�˼��ٷ�Һ�ŷš��������������Դ����ҵ�Ͻ���Һ1��������ͭ��Һ����ѭ����������ָ������ͼ����һ�����Ƶ�����________________________��
��5�������ӷ���ʽ��ʾ����̼������Һ�����ã�___________________________��[��֪298 Kʱ��Ksp(PbCO3)��1.46��10��13��Ksp(PbSO4)��1.82��10��8]������Һ��c(SO42-)=0.2mol/Lʱ��c(CO32-)=_______________mol/L�����������2λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:��2H2(g)+O2(g)![]() 2H2O(l)����H=-571.6 kJ��mol-1
2H2O(l)����H=-571.6 kJ��mol-1
��2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)����H=-1 452 kJ��mol-1
2CO2(g)+4H2O(l)����H=-1 452 kJ��mol-1
��H+(aq)+OH-(aq)![]() H2O(l)����H=-57.3 kJ��mol-1
H2O(l)����H=-57.3 kJ��mol-1
����˵����ȷ����
A. H2(g)��ȼ����Ϊ142.9 kJ��mol-1
B. ͬ������H2(g)��CH3OH(l)��ȫȼ��,H2(g)�ų���������
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l)����H=-57.3 kJ��mol-1
1/2BaSO4(s)+H2O(l)����H=-57.3 kJ��mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l)����H=+131.4 kJ��mol-1
CH3OH(l)+H2O(l)����H=+131.4 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ѧ����ѧϰ��ͬѧ�Ƕ��������Ļ����������˽�һ���˽⡣
��1������H��C��N��O��K����Ԫ�أ���ѡ�����е�Ԫ��д���������ʵĻ�ѧʽ��
����Ȼ������Ҫ�ɷ�____��
�ڼ�����Ѫ�쵰��ϵ��ж�����____��
���ܹ�������������____��
�ܿ������Ϸʵ������____��
��2����ͼ��ij��ʯ��Ʒ�и���Ԫ�غ����ı���ͼ��

�ٸ���ʯ�к�____�ַǽ���Ԫ�أ����к�����������____Ԫ�ء�
�������ӵĽṹʾ��ͼΪ ����X��____��
����X��____��
�۴���ʯ��Ʒ�в����ܺ��еĻ�������____��
A��CaCO3 B��K2SO4 C��Al2O3 D��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ��ʵ�飬��x���ʾ���������ĵ��ӵ����ʵ�������y��Ӧ��ʾ( )
��c(Ag+) ��c(NO3-) ��a�������� ��b�������� ����Һ������
A. �� �� B. �� �� C. �� �� �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��Ӧ�ù㷺�Ľ�����ij��ȤС��Խ�����չ����ϵ���о���
I���о����Ļ�ѧ����
��1�����ڳ����»���������Ӧ�������γ�һ�����ܵ�����Ĥ����ѧ����ʽΪ______��ʵ��ǰ����Ҫ�����ı����Ƚ���______�����������������ȤС��ͬѧ���������ú�������ɴ�С��ͬ��СƬ�����ں���ʵ�顣
��2�������ᡢ�����Һ�ķ�Ӧ
ʵ�� | ���� | ���� | ���� |
һ | ����Ƭ����ϡ������ | ���Թܱ��� | ���������ᷢ����Ӧ����Ӧ���� |
�� | ����Ƭ��������������Һ�� | �����������ݲ����Թܱ��� | ����������������Һ��Ӧ����Ӧ���� |
�� | ������������ͭ��Һ�� | �������к�ɫ���ʲ�������Һ�����ɫ | ������ԣ��� ͭ |
ʵ��һ������Ϊ_____��
ʵ����������ϣ������������ơ�ˮ��Ӧ����ƫ�����ƣ�NaAlO2������������Ӧ�Ļ�ѧ����ʽΪ____��ʵ�������������Ľ������____������ڡ���С�ڡ���ͭ��
��3��С��ͬѧ��ʵ��һ�е�ϡ���ỻ�ɵ�������������Ũ����ͬ��ϡ���ᣬ��ͬʱ���ڷ�����Ƭ������������ݽ��٣���Ӧ�������Ա���������ʵ��������롣����٣�ϡ�����е������ӶԷ�Ӧ�����дٽ����á�����ڣ�____��Ϊ��֤������Ƿ������Ӧ������ϡ�����м���____������ĸ�����۲�����
A��Na2SO4 B��Na2CO3 C��NaCl
II���ⶨij����Ʒ�н���������������
������1������������������������Һ��Ӧ�������백ˮ��Ӧ��
������2��AlCl3+3NaOH��Al(OH)3��+3NaCl��AlCl3+3NH3H2O��Al(OH)3��+3NH4Cl��
��4��С��ͬѧ��ȡ4.62gij��������Ʒ����Ʒ�����ʽ�Ϊ��������������ͼһ��ƿ�У���������ϡ��������ȫ��Ӧ������Ӧ���Һ��ֳ���Һ1����Һ2���ȷݣ��������ʵ�鷽������ͼ������ͨ�����������ⶨ��Ʒ�н�����������������

��ѡ����ȷ��һ��ʵ�鷽����������Ʒ�н�������������������д��������̣���_____��
��С��ͬѧ���ͼһ��ͼ��װ�ò������������ƿ�з�Ӧֹͣ��������Ͳ��ˮ�������������ֽ���������������ƫ���ܵ�ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��S��ClԪ�صĵ��ʼ��������ڹ�ҵ�����е���Ч���ñ��ܹ�ע����ش��������⣺
��1����֪��I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) ��H1��
��.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) ��H2��
HCl(aq)+HClO(aq) ��H2��
��.2HClO(aq) ===2HCl(aq)+O2(g) ��H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) ��H4=____________________(�ú��С�H1����H2�͡�H3�Ĵ���ʽ��ʾ)��
��2��25��ʱ��H2SO3��Һ�и������������ʵ�������(��)����ҺpH�ı仯��ϵ��ͼ����ʾ��
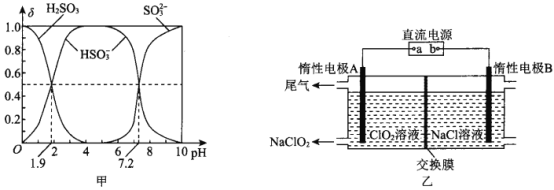
��֪25��ʱ��NaHSO3��ˮ��ҺpH��7����ͼ�е�����ͨ���������ԭ�� ____________________��
��3��NaClO2��һ����ɫ��������Ư������ҵ�ϲ��õ�ⷨ�Ʊ� NaClO2��ԭ����ͼ����ʾ��
�ٽ���ĤӦѡ��____________________(������ӽ���Ĥ���������ӽ���Ĥ��)
�������ĵ缫��ӦʽΪ________________________________________��
��4��һ���¶��£���2L�����ܱ�������ͨ��2molCO��1molSO2��������Ӧ2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ��H=-270kJ/mol������Ӧ���е�20minʱ��ƽ�⣬���CO2���������Ϊ0.5����ǰ20min�ķ�Ӧ����v(CO)= _________�����¶��·�Ӧ��ѧƽ�ⳣ��K=____________��L��mol-1��
S(l)+2CO2(g) ��H=-270kJ/mol������Ӧ���е�20minʱ��ƽ�⣬���CO2���������Ϊ0.5����ǰ20min�ķ�Ӧ����v(CO)= _________�����¶��·�Ӧ��ѧƽ�ⳣ��K=____________��L��mol-1��

��5���ڲ�ͬ�����£���2L�����ܱ�������ͨ��2molCO��1molSO2����Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��I����ʾ��
��ͼ��I��������ʵ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��v(CO)����Ϊ___________������ţ�
����ʵ��a��ȣ�c��ı��ʵ������������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ͨѶ����ͨ���ճ����������Ź㷺��Ӧ�á�
��1��Zn��MnO2�ɵ��Ӧ�ù㷺����������Һ��ZnCl2��NH4Cl�����Һ���õ�صĸ���������______����ع���ʱ����������______�������������������
��ZnCl2��NH4Cl�����Һ�к�������Cu2+�������ij�缫�ķ�Ӧ������Ҫԭ����_________________��
��2��Ǧ�����dz��õĻ�ѧ��Դ����缫���Ϸֱ���Pb��PbO2�����ҺΪ���ᡣ�õ���ܷ�ӦʽΪ��
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O���������������жϣ�
2PbSO4+2H2O���������������жϣ�
�����طŵ�ʱ���������Һ������������_____________�����������������������������Һ������_______�����ǿ���������������䡱���ŵ�ʱ�������ĵ缫��ӦʽΪ��________________��
��3������ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㣬�������ܶȸ���Ǧ���ء��������ΪKOH��Һ��������ȼ�ϵ�صĸ�����ӦʽΪ_________________________________���õ�ع���ʱ�����·ÿ����2 mole-�����ı��������____________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ� 2 mol ����A �� 1 mol ����B ����һ���������������ڣ�������Ӧ��2A+B C+3D+4E���ﵽƽ�������A ��Ũ�ȼ���һ�룬������Һ�����ɣ�����ͬ���¶��²�÷�Ӧ ǰ��ѹǿ�ֱ�Ϊ 6.06��106 Pa �� 8.08��106 Pa���ֲ�÷�Ӧ���ų����� Q kJ������˵����ȷ����( )
A. �÷�Ӧ���κ��¶��¶����Է�����
B. ������ƽ����ϵ���ټ��� 1 mol A �� 0.5 mol B��ƽ�������ƶ���A ��ת��������
C. �÷�Ӧ���Ȼ�ѧ����ʽΪ 2A(g)+B(g) C(g)+3D(l)+4E(g) ��H= -Q kJ/mol
D. ������Ӧ�ﵽƽ����������������������£������¶ȣ�ѹǿһ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com