
【题目】咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用。其球棍模型如图所示,关于咖啡酸的下列说法正确的是
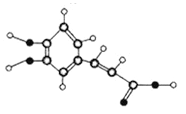
A. 分子式为C9H10O4
B. 分子中至少有9个碳原子共平面
C. 1 mol咖啡酸与足量NaHCO3反应生1 mol CO2
D. 1 mol咖啡酸最多能够与5 mol H2发生加成反应
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是 )
A. cOH)=cH+)的溶液 B. 盐溶液
C. pH=3的酸与pH=11的碱等体积混合所得溶液 D. pH=7的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A. CH4+Cl2![]() CH3Cl + HCl
CH3Cl + HCl
B. H2+ Cl2![]() 2HCl
2HCl
C. CH2=CH2+ H2O![]() CH3CH2OH
CH3CH2OH
D. 2NaOH + Cl2=NaClO + NaCl + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO(g)+2H2(g)CH3OH(g)△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是 .
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: .
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题: 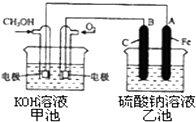
①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②写出电极A的名称 . 写出B电极的电极反应式 .
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列说法错误的是( )
A.常温常压下,1 mol氦气含有的核外电子数为2NA
B.1.7gCH5+离子中含有的电子总数为NA
C.1molC10H22分子中共价键总数为31 NA
D.1molNO2与足量水反应时共转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:

该有机分子的核磁共振氢谱图如下(单位是ppm):

下列关于该有机物的叙述正确的是 ( )
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO 的制备原理:HCOOH ![]() CO↑+H2O。
CO↑+H2O。
(1)正丁醛经催化加氢得到含少量正丁醛的 1-丁醇粗品。为纯化 1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) →RCH(OH)SO3Na↓;
②沸点:乙醚 34℃,1-丁醇 118℃,并设计出如下提纯路线:
![]()
试剂1为 ,操作3为 。
(2)原料气CH3CH=CH2、CO和H2的制备装置图设计如下:
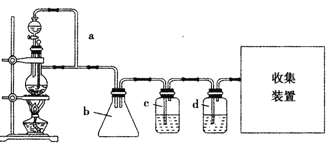
填写下列空白:
①若用上述装置制备干燥纯净的CO气体,装置b的作用是 ;c中盛装的试剂是 。
②若用上述装置制备氢气,收集装置可选用下列装置
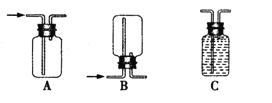
③实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯,写出反应的化学方程式: 。 制丙烯时,产生的气体除了丙烯及水蒸气外,还存在CO2、SO2;为检验这四种气体,下列装置按气流方向的连接顺序为 。
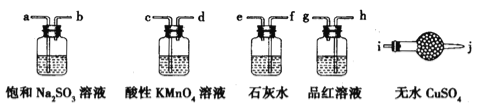
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3: 物质结构与性质】
(1)CH3COONH2 分子中各元素第一电离能大小顺序__________,该物质中碳原子杂化方式为_______________________________。
(2)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4) 等弱碱。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
比较上表中氨(NH3)、联氨(N2H4) 的熔、沸点,解释其高低的主要原因________,![]() 的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
的离域π键表示为________________________,与NH3 互为等电子体的阳离子有__________。
(3)浅红色Cr [(H2O)3(NH3)3]Cl3中铬离子价电子排布式为__________________。
(4)SiC具有高硬度,高耐磨性,高耐腐蚀性和较高的高温强度特点,已成为一种重要的工程材料,其晶体具有六方ZnS 型结构。晶胞参数a=308pm,c=505pm,已知C原子的分数坐标(0,0,0)和(![]() ,
,![]() ,
,![]() );Si原子的分数坐标(0,0,
);Si原子的分数坐标(0,0,![]() )和((
)和((![]() ,
,![]() ,
,![]() )
)
①按比例在下框中商出SiC 六方晶胞_______

②列式计算Si-C的键长_______(保留整数部分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com