
���� ��1������v=$\frac{��c}{��t}$����ƽ����Ӧ���ʣ�
��2���μӷ�Ӧ��B�����ʵ���Ϊ��1-0.8��mol=0.2mol����B�ķ�Ӧ����=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/L��ͬһ���淴Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ��Ӷ�����xֵ��
��3����Ϊ�ɣ�2���ó�x=4����÷�ӦΪǰ�����岻��ķ�Ӧ�������ٳ���amolC��ԭƽ��ɱ�����Ч���ݴ˷�����
��4�����Ũ����С��ƽ�ⳣ������ƽ�����ҷ�Ӧ�����ƶ���
��5����Ӧ3A��g��+B��g��?4C��g���У���������ڷ�Ӧǰ����ͬ����һ���¶��£��ں����ܱ������еõ�ƽ��״̬��ֻҪ��������ȫ��ת��ΪA��B��������n��A����n��B��=1��1�����ɵõ���ͬƽ��״̬����Ҫƽ���A�������������a%��˵��ƽ�������ƶ������ݵ�Чƽ�⣬�����ʶ�����ɷ���ʽһ�ߵ����ʣ�����n��A����n��B����1��1���ɣ�
��� �⣺��1������C��ƽ����Ӧ����v=$\frac{��c}{��t}$=$\frac{0.4mol/L}{2min}$=0.2mol/��L��min�����ʴ�Ϊ��0.2mol/��L��min����
��2���μӷ�Ӧ��B�����ʵ���Ϊ��1-0.8��mol=0.2mol����B�ķ�Ӧ����=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/L��C��ƽ����Ӧ����Ϊ0.2mol/��L��min����ͬһ���淴Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ�B��C�ļ�����֮�ȵ����䷴Ӧ����֮��=0.05mol/��L��min����0.2mol/��L��min��=1��4������x=4��
�ʴ�Ϊ��4��
��3����Ϊ3molA��1molB����ͨ�뵽��ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8molB������Ч�ڽ�4molCͨ�룬ƽ��ʱ����0.8molB��
���ɣ�2���ó�x=4����÷�ӦΪǰ�����岻��ķ�Ӧ�������ٳ���amolC�뽫4molCͨ��ɱ�����Ч�����ֻ�����$\frac{0.8}{4}$amol=0.2amolB��
���Դ�ʱB�����ʵ���Ϊn��B��=0.8mol+0.2amol=��0.8+0.2a ��mol��
�ʴ�Ϊ��0.8+0.2a��
��4����һ��ƽ��ʱA�����ʵ���Ũ��=$\frac{3-��1-0.8����3}{2}$mol/L=1.2mol/L��B�����ʵ���Ũ��=$\frac{0.8mol}{2L}$=0.4mol/L��C�����ʵ���Ũ��=0.4mol/L����ѧƽ�ⳣ��K=$\frac{��0.4��{\;}^{4}}{��1.2��{\;}^{3}��0.4}$=$\frac{1}{27}$�����Ũ����С��ƽ�ⳣ������ƽ�����ҷ�Ӧ�����ƶ���
A��������ʱ����Ũ�Ⱦ���ԭ����һ�룬��Ũ����=$\frac{��\frac{1}{2}��{\;}^{4}}{��\frac{1}{2}��{\;}^{3}��\frac{1}{2}}$=K������ƽ�ⲻ�ƶ����ʴ���
B�����ӱ�ʱ����Ũ�Ⱦ���ԭ���Ķ�������Ũ����=$\frac{2{\;}^{4}}{2{\;}^{3}��2}$=K������ƽ�ⲻ�ƶ����ʴ���
C��������0.4mol����Ũ�Ⱦ�����0.2mol/L����Ũ����=$\frac{��0.4+0.2��{\;}^{4}}{��1.2+0.2��{\;}^{3}����0.4+0.2��}$=��$\frac{3}{7}$��3��$\frac{1}{27}$��ƽ������Ӧ�����ƶ����ʴ���
D��������0.4mol����Ũ�Ⱦ�����0.2mol/L����Ũ����=$\frac{��0.4-0.2��{\;}^{4}}{��1.2-0.2��{\;}^{3}����0.4-0.2��}$=��$\frac{1}{5}$��3��$\frac{1}{27}$����ƽ�����ҷ�Ӧ�����ƶ�������ȷ��
��ѡ��D��
��5����Ӧ3A��g��+B��g��?4C��g���У���������ڷ�Ӧǰ����ͬ����һ���¶��£��ں����ܱ������еõ�ƽ��״̬��ֻҪ��������ȫ��ת��ΪA��B��������n��A����n��B��=1��1�����ɵõ���ͬƽ��״̬����Ҫƽ���A�������������a%��˵��ƽ�������ƶ������ݵ�Чƽ�⣬�����ʶ�����ɷ���ʽһ�ߵ����ʣ�����n��A����n��B����1��1���ɣ�
A.2molC��ȫת��Ϊ1.5molA��0.5molB���������ʵ���֮��Ϊ3��1��1��1����A��ȷ����������������
B��1molA��3molB��4molC��ȫת��ΪA��Bʱ��A�����ʵ���Ϊ4molA��4molB�����ߵ����ʵ���֮�ȵ���1��1����Чƽ�⣬��A���������Ϊa%����B����
C��1mol B��4molC��C��ȫת��ΪA��Bʱ��A�����ʵ�����3mol��B�����ʵ���Ϊ2mol��A��B�����ʵ���֮��1.5��1����C��ȷ������
D��6molA��2molB�����ߵ����ʵ���֮��Ϊ3��1��1������ƽ��ʱA�������������a%����D��ȷ��
��ѡ��ACD��
���� ���⿼�黯ѧƽ����㣬�漰ƽ�ⳣ���ļ��㡢��Чƽ�⡢��ѧ�������ļ����֪ʶ�㣬�����Ũ���̺ͻ�ѧƽ�ⳣ������Դ�С�ж�ƽ���ƶ������ѵ��ǵ�Чƽ��ļ��㣬�ѵ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 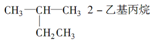 | B�� | CH3CH2CH2CH2OH 1-���� | ||
| C�� | 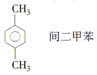 | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾ�٢ڢֱܷۢ��Ǽ��ֳ���©�����ϲ���A��B��C��D��ʵ�ʲ���Ӧ��ʱ����©�����²����������е�ʾ��ͼ����ָ��A��B��C��D�ֱ���٢ڢۢ���ƥ��Ŀ�����ϣ�A��ۣ� B��ڢܣ���٢ڢܣ���C��٣� D��ܣ�
��ͼ��ʾ�٢ڢֱܷۢ��Ǽ��ֳ���©�����ϲ���A��B��C��D��ʵ�ʲ���Ӧ��ʱ����©�����²����������е�ʾ��ͼ����ָ��A��B��C��D�ֱ���٢ڢۢ���ƥ��Ŀ�����ϣ�A��ۣ� B��ڢܣ���٢ڢܣ���C��٣� D��ܣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
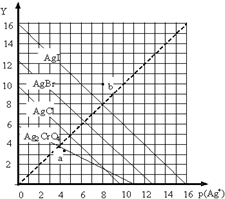 һ���¶��£�±����AgX��X��Cl-��Br-��I-����Ag2CrO4�ij����ܽ�ƽ��������ͼʾ��������p��Ag+����ʾ��-lgc��Ag+������������Y��ʾ��-lgc��X-������-lgc��CrO42-����������˵����ȷ���ǣ�������
һ���¶��£�±����AgX��X��Cl-��Br-��I-����Ag2CrO4�ij����ܽ�ƽ��������ͼʾ��������p��Ag+����ʾ��-lgc��Ag+������������Y��ʾ��-lgc��X-������-lgc��CrO42-����������˵����ȷ���ǣ�������| A�� | a���ʾc��Ag+��=c��CrO42-�� | |
| B�� | b��ɱ�ʾAgI�ı�����Һ | |
| C�� | ���¶���AgI��KspԼΪ1��10-16 | |
| D�� | ���¶���AgCl��AgBr������Һ�У�c��Cl-����c��Br-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ƿ���������ȵķ�Ӧ�� | |
| B�� | �����£����ܽ�Ũ����ʢ������Ͱ�� | |
| C�� | ��50mL��Ͳ������0.1000mol•L-1̼������Һ | |
| D�� | ������ˮ��ʪ����ֽ����Һ��pH��һ����ʹ���ƫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 42g NaHCO3�����к���CO32-����ĿΪ0.5NA | |
| B�� | 1 mol OH-��17 g NH3�����ĵ�������� | |
| C�� | 1 mol Cl2�μӷ�Ӧת�Ƶ�����һ��Ϊ2NA | |
| D�� | 2.0g H216O��D216O�Ļ����������������ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
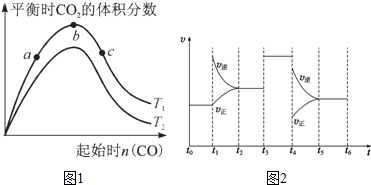
| A�� | ���������������䣬�����¶ȣ�H2SŨ�����ӣ������÷�Ӧ�����ȷ�Ӧ | |
| B�� | ͨ��CO������Ӧ���������� | |
| C�� | ��ӦǰH2S���ʵ���Ϊ7 mol | |
| D�� | CO��ƽ��ת����Ϊ80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HClO�����ᣬ����NaClO��������� | |
| B�� | CCl4�����ڼ�����ˮ�͵�ˮ | |
| C�� | Ư���ڿ����в��ȶ�����˿�����Ư��ֽ�� | |
| D�� | ���Ҵ���ȡ�ķ������Է�������ˮ�ĵ⣬����Ϊ�����Ҵ��е��ܽ�Ƚϴ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com