
| A. | NiOOH | B. | Ni(OH)2 | C. | Cd | D. | Cd(OH)2 |
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
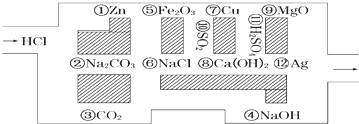
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
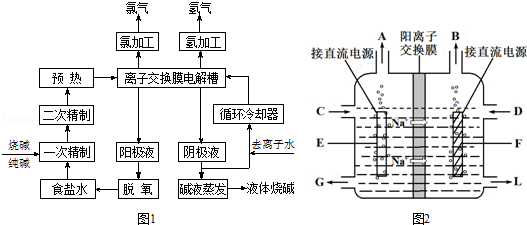
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(Na+)=0.2 mol•L-1 | |
| B. | 电解后溶液中c(H+)=0.4mol•L-1 | |
| C. | 上述电解过程中共转移0.4 mol电子 | |
| D. | 电解后得到的Cu的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
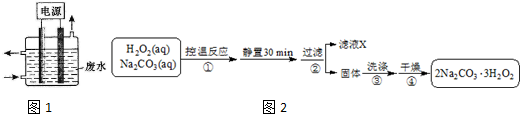
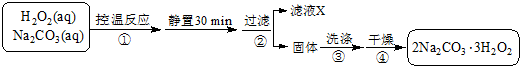
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com