
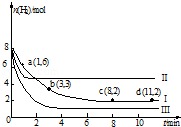
 һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������
һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������| A�� | �÷�Ӧ��0��8 min��CO2��ƽ����Ӧ������ 0.375 mol•L-1•min-1 | |
| B�� | ����ʼʱ�����������г���3 mol CO2��4 mol H2����ƽ��ʱH2�������������20% | |
| C�� | ����ʼʱ�����������г���4 mol CO2��2 mol H2��2 mol CH3OH��1mol H2O��g�������ʱ��Ӧ������Ӧ������� | |
| D�� | �ı������õ����ߢ������ߢ�ı�������ֱ��������¶ȡ����뺤�� |
���� A������v=$\frac{��c}{��t}$����v��H2��������������֮�ȵ����仯ѧ������֮�ȼ���v��CO2����
B����ͼ��֪��Iƽ��ʱ����Ϊ2mol����������ʽ����ƽ��ʱ��������ʵ������������������������������ʼʱ�����������г���3 mol CO2��4 mol H2����ЧΪԭƽ��ѹǿ��Сһ����ƽ�����淴Ӧ�����ƶ��������������������
C������B�м����֪ƽ��ʱ������̼���������״���ˮ��Ũ�ȣ�����ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$����ƽ�ⳣ�����ټ����ʱ��Ũ����Qc����ƽ�ⳣ���Ƚϣ��жϷ�Ӧ���з���
D�������ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ�ȴ�˵���ı�������Ӧ���ʼӿ졢��Ӧ���淴Ӧ�����ƶ�����I��ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ��С��˵���ı�������Ӧ���ʼӿ졢��Ӧ������Ӧ�����ƶ���
��� �⣺A����ͼ��֪��0��8 min��H2�����ʵ����仯��Ϊ8mol-2mol=6mol����v��H2��=$\frac{\frac{6mol}{2L}}{8min}$=0.375 mol•L-1•min-1������֮�ȵ����仯ѧ������֮�ȣ���v��CO2��=$\frac{1}{3}$v��H2��=0.125 mol•L-1•min-1����A����
B����ͼ��֪��Iƽ��ʱ����Ϊ2mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol����6 8 0 0
ת����mol����2 6 2 2
ƽ�⣨mol����4 2 2 2
��I��ƽ��ʱ�����������Ϊ��$\frac{2mol}{4mol+2mol+2mol+2mol}$=20%������ʼʱ�����������г���3 mol CO2��4 mol H2����ЧΪԭƽ��ѹǿ��Сһ����ƽ�����淴Ӧ�����ƶ��������������������ƽ��ʱH2�������������20%����B��ȷ��
C��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$=$\frac{1��1}{2��{1}^{3}}$=0.5����ʱ��Ũ����Qc=$\frac{\frac{2}{2}��\frac{1}{2}}{\frac{4}{2}����\frac{2}{2}��^{3}}$=0.25��K=0.5����ƽ��������Ӧ�����ƶ�����C��ȷ��
D�������ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ�ȴ�˵���ı�������Ӧ���ʼӿ졢��Ӧ���淴Ӧ�����ƶ����������¶ȣ���Ӧ���ʼӿ죬����ӦΪ���ȷ�Ӧ��ƽ�����淴Ӧ�����ƶ����������⣻��I��ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ��С��˵���ı�������Ӧ���ʼӿ졢��Ӧ������Ӧ�����ƶ��������뺤������Ӧ��������ֵ�Ũ�Ȳ��䣬��Ӧ���ʲ��䡢ƽ�ⲻ�ƶ������������⣬��D����
��ѡBC��
���� ���⿼�黯ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰���ʵ�����ʱ��仯���ߡ���Ӧ����Ӱ�����ؼ����㡢��ѧƽ��Ӱ����������㡢ƽ�ⳣ��Ӧ�õ�֪ʶ�����ؿ���ѧ����������������C��ע������ƽ�ⳣ���жϷ�Ӧ���з�������������ѧ���ķ�����������������ѧ����������


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Һ�ı��������Ƿ�ɢ�ʿ����Ĵ�С��ͬ | |
| B�� | �Ȼ�����Һ��Ӧ��ֹѪ�����õ��ǽ���ľ۳� | |
| C�� | ��Һ�ǵ����Եģ������Ǵ���� | |
| D�� | ��ϡ������μ����������������У���ʼʱ���������������μ�ʱ�������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��CO2��CO | B�� | CO��H2��H2O | C�� | HCl��CO2��H2 | D�� | HCl��CO2��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| 1 | NaCl | NaHCO3 | NH4Cl |
| 10�� | 35.8 | 8.15 | 33.0 |
| 45�� | 37.0 | 14.0 | 50.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ���ྻú�������о����������൱�ձ飮
���ྻú�������о����������൱�ձ飮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/K | ��ӦI | ��ӦII | ��֪�� K2��K1��K2�䣾K1�� |
| 298 | K1 | K2 | |
| 398 | K1�� | K2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com