
分析 计算10.8g有机物中含有碳元素、氢元素物质的量及质量,根据守恒定律确定是否含有元素,若含有氧元素,计算氧元素物质的量,进而计算有机物最简式,结合相对分子质量确定有机物分子式,再结合有机物能与金属钠反应,也能与NaOH溶液反应,判断分子中官能团书写可能的结构简式和名称.
解答 解:该有机物的摩尔质量为:$\frac{27g}{0.25mol}$=108g/mol,7.2gH2O中H原子的物质的量为:$\frac{7.2g}{18g/mol}$×2=0.8mol,标况下15.68LCO2的物质的量为:$\frac{15.68L}{22.4L/mol}$=0.7mol,则n(C)=0.7mol,
10.8g有机物中m(C)+m(H)=0.7mol×12g/mol+0.8mol×1g/mol=9.2g,故10.8g有机物中m(O)=10.8g-9.2g=1.6gg,则n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,
所以n(C):n(H):n(O)=0.7mol:0.8mol:0.1mol=7:8:1,该有机物的最简式为C7H8O,分子式为(C7H8O)n,又因相对分子质量为108,即108n=108,解得n=1,所以该有机物的分子式为:C7H8O;
有机物具有弱酸性,能与金属钠反应,也能与氢氧化钠溶液反应,所以一定含有酚羟基,即:该有机物分子中一定含有苯环和羟基,则应该还会有1个甲基,其可能的结构简式和名称为: 对甲基苯酚、
对甲基苯酚、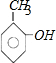 邻甲基苯酚、
邻甲基苯酚、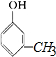 间甲基苯酚,
间甲基苯酚,
答:该有机物的分子式为C7H8O;其可能的结构简式和名称为 对甲基苯酚、
对甲基苯酚、 邻甲基苯酚、
邻甲基苯酚、 间甲基苯酚.
间甲基苯酚.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--CO2 | B. | 光化学污染--NO2 | C. | 酸雨--SO2 | D. | 臭氧层破坏--CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
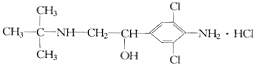
| A. | 摩尔质量为313.5 g | B. | 属于芳香烃 | ||
| C. | 分子式为C12H19Cl3N20 | D. | 消去产物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:D>E>C>B>A | |
| B. | 热稳定性:EA4>A2C | |
| C. | 单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
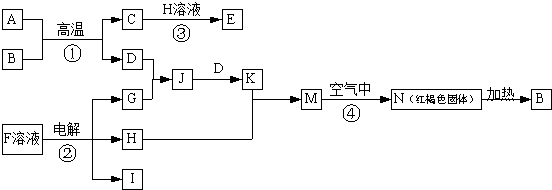
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com