
分析 (1)溶液稀释过程中溶质的物质的量保持不变,依据C1V1=C2V2解答;
(2)根据配制一定物质的量浓度溶液的一般实验操作的步骤解答;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸,设需要浓溶液体积为V,则依据溶液稀释过程中溶质的物质的量保持不变得:18mol/L×V=100mL×3.0mol/L,
解得V=16.7mL;
故答案为:16.7mL;
(2)用浓硫酸配制稀硫酸一般操作步骤为:计算、量取、稀释、冷却移液、洗涤、定容、摇匀等,所以第③步操作为浓硫酸的稀释:将浓硫酸沿着烧杯壁缓缓注入水中,同时不断用玻璃棒不断搅拌;
故答案为:稀释(将浓硫酸沿着烧杯壁缓缓注入水中,同时不断用玻璃棒不断搅拌)
(3)A.所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸吸水浓度降低,导致量取的浓硫酸中硫酸物质的量偏小,溶液浓度偏小,
故答案为:偏小;
B.容量瓶用蒸馏洗涤后残留有少量的水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度无影响,
故答案为:无影响;
C.所用过的烧杯、玻璃棒未洗涤,导致溶质部分 损耗,溶质的物质的量偏小,溶液浓度偏小,
故答案为:偏小;
D.定容时俯视溶液的液凹面,导致溶液体积偏小,溶液浓度偏大,
故答案为:偏大.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意从c=$\frac{n}{V}$进行误差分析,注意浓硫酸的稀释操作.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
 +NaOH→
+NaOH→ +H2O
+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H8+x-2yR | B. | H8-x+2yR | C. | Hx-2yR | D. | H2y-xR |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
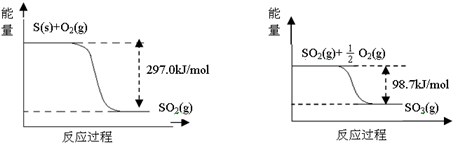
| A. | 1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ | |
| B. | 在相同条件下,SO3(g)比SO2(g)稳定 | |
| C. | 1molSO2(g)和$\frac{1}{2}$molO2(g)生成1molSO3(g)放出98.7kJ的热量 | |
| D. | 由图得S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-198.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO→Na2CO3+2HclO | |
| B. | HCN+Na2CO3→CO2+2NaCN+H2O | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数比较:Ki1(H2CO3)>Ki2(H2CO3)>Ki(C6H5OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸在玻璃器皿上刻蚀标记 | B. | 液氨用作制冷剂 | ||
| C. | 铁粉作食品袋内的脱氧剂 | D. | 漂粉精作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
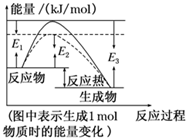 可逆反应N2+3H2?2NH3是工业上合成氨的重要反应.
可逆反应N2+3H2?2NH3是工业上合成氨的重要反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com