
| A、元素的非金属性:X>Y>Z |
| B、原子序数:X>Y>Z |
| C、气态氢化物的稳定性:XH3>YH3>ZH3 |
| D、气态氢化物的还原性:XH3<YH3<ZH3 |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3ˉ、Clˉ |
| B、K+、Na+、Clˉ、NO3ˉ |
| C、K+、Na+、Clˉ、AlO2ˉ |
| D、K+、NH4+、SO32ˉ、NO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中铁单质物质的量的范围:0.03 mol<n(Fe)<0.07 mol |
| B、往得到的溶液中加入NaOH溶液现象为白色沉淀转化为灰绿色最后变为红褐色 |
| C、混合物里FeO的量无法确定,也不好比较Fe物质的量和Fe2O3物质的量的多少 |
| D、反应后所得溶液中的Fe2+与Cl-的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
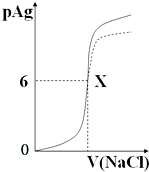 已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )(提示:KspAgCl>KspAgI)
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )(提示:KspAgCl>KspAgI)| A、原AgNO3溶液的物质的量浓度为0.1 mol?L-1 |
| B、图中x点的坐标为(10,6 ) |
| C、图中x点表示溶液中Ag+ 与Cl-浓度相同 |
| D、把0.1 mol?L-1的NaCl换成0.1 mol?L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
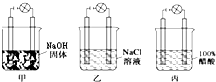 某化学兴趣小组在实验室进行化学实验,按照图甲、乙、丙连接好线路,发现甲灯泡不亮,乙灯泡亮,丙灯泡不亮.由此得出的结论正确的是( )
某化学兴趣小组在实验室进行化学实验,按照图甲、乙、丙连接好线路,发现甲灯泡不亮,乙灯泡亮,丙灯泡不亮.由此得出的结论正确的是( )| A、醋酸是非电解质 |
| B、NaOH固态时不是电解质 |
| C、NaCl溶液是电解质 |
| D、NaCl在水分子作用下电离出了可以自由移动的离子而导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9.0 | B、9.5 |
| C、8.5 | D、10.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A>B |
| B、A=10-4B |
| C、B=10-4 A |
| D、A=B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com