
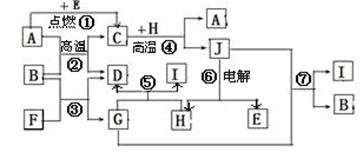
 Fe3O4+4H2 (2分) Al2O3+2NaOH=2NaAlO2+H2O(2分)
Fe3O4+4H2 (2分) Al2O3+2NaOH=2NaAlO2+H2O(2分) Fe3O4+4H2;氧化铝是两性氧化物,和氢氧化钠溶液反应的方程式是Al2O3+2NaOH=2NaAlO2+H2O。
Fe3O4+4H2;氧化铝是两性氧化物,和氢氧化钠溶液反应的方程式是Al2O3+2NaOH=2NaAlO2+H2O。

 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源:不详 题型:填空题
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
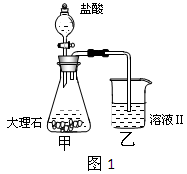
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
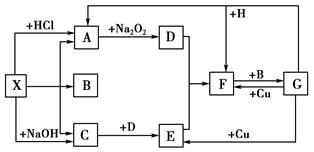
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
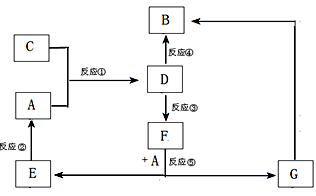
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 色 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
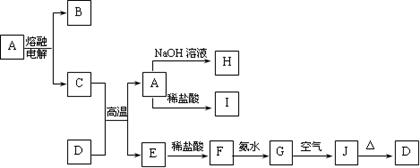
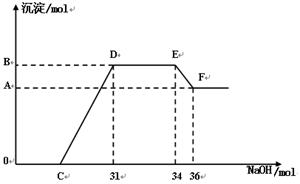
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
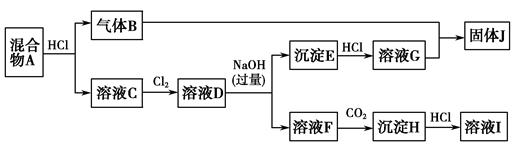
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
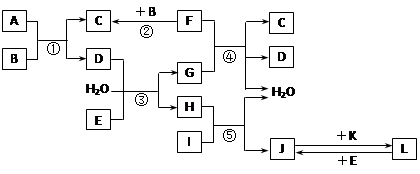
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
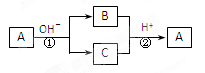
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 |
| B.Fe3+的最外层电子排布式为:3s23p63d5 |
C.硫离子的结构示意图为: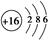 |
D.基态碳原子的电子排布图: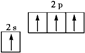 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com