
”¾ĢāÄæ”æA”¢B”¢CĪŖ֊ѧ³£¼ūµ„ÖŹ£¬ĘäÖŠŅ»ÖÖĪŖ½šŹō£»Ķس£ĒéæöĻĀ£¬AĪŖ¹ĢĢ壬BĪŖŅŗĢ壬CĪŖĘųĢ唣D”¢E”¢F”¢G”¢H”¢X¾łĪŖ»ÆŗĻĪļ£¬ĘäÖŠXŹĒŅ»ÖÖĪŽŃõĒæĖį”¢EĪŖŗŚÉ«¹ĢĢ壬HŌŚ³£ĪĀĻĀĪŖŅŗĢ唣ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾(Ęä֊ijŠ©·“Ó¦Ģõ¼žŗĶ²æ·Ö·“Ó¦ĪļŅŃĀŌČ„)”£

£Ø1£©Š“³ö»ÆѧŹ½£ŗA_________”¢D_________”¢E__________”¢X__________”£
£Ø2£©ŌŚ·“Ó¦¢Ł”«¢ßÖŠ£¬²»ŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ________(Ģī±ąŗÅ)”£
£Ø3£©·“Ó¦¢ŽµÄĄė×Ó·½³ĢŹ½ĪŖ_________________________£»
£Ø4£©·“Ó¦¢ßµÄ»Æѧ·½³ĢŹ½ĪŖ____________________£»øĆ·“Ó¦ÖŠĆæĻūŗÄ0.3 molµÄA£¬æÉ×ŖŅʵē×Ó________mol”£
£Ø5£©·Ö±šŠ“³öDµÄČÜŅŗÓėŠ”ĖÕ“ņČÜŅŗ”¢DµÄČÜŅŗÖŠĶØČĖÉŁĮæSO2·“Ó¦µÄĄė×Ó·½³ĢŹ½___________________”£
”¾“š°ø”æ£Ø1£©Fe£»FeBr3£»Fe3O4£»HBr£»
£Ø2£©¢Ū¢Ž£»£Ø3£©Fe3++3SCN-==Fe(SCN)3 £»
£Ø4£©3Fe+4H2O(g)![]() Fe3O4+4H2£»0.8£»
Fe3O4+4H2£»0.8£»
£Ø5£©Fe3++3HCO3-=Fe(OH)3”ż+3CO2”ü£»2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA”¢B”¢CĪŖ֊ѧ³£¼ūµ„ÖŹ£¬µ„ÖŹ¹ĢĢåAŗĶĘųĢåC·“Ӧɜ³ÉEĪŖŗŚÉ«¹ĢĢ壬EŗŚÉ«¹ĢĢåŗĶXĖį·“Ӧɜ³ÉD”¢G”¢H£¬ĘäÖŠD”¢GÖ®¼äæÉŅŌŹµĻÖĻą»„×Ŗ»Æ£¬ĖµĆ÷AĪŖ±ä¼Ū½šŹōFe£¬ŗĶCŌŚµćČ¼Ģõ¼žĻĀÉś³ÉŗŚÉ«¹ĢĢåEĪŖFe3O4£¬CĪŖO2£¬ŅĄ¾ŻD+A=GĖµĆ÷DĪŖŗ¬Čż¼ŪĢśĄė×ӵĻÆŗĻĪļ£¬FĪŖŗ¬ĮņĒčĖįøłĄė×ӵĻÆŗĻĪļ£¬GĪŖŗ¬Fe2+Ąė×ӵĻÆŗĻĪļ£¬HĪŖH2O£»ŅĄ¾ŻG+B=D·ÖĪöÅŠ¶ĻBŹĒĒæŃõ»Æ¼Į£¬³£ĪĀĻĀĪŖŅŗĢåµÄŃõ»Æ¼Įµ„ÖŹĪŖBr2£¬æÉĶʶĻDĪŖFeBr3£¬GĪŖFeBr2£»XĪŖHBr”£
£Ø1£©øł¾ŻÉĻŹö·ÖĪö£¬AĪŖFe£»DĪŖFeBr3£»EĪŖFe3O4£»XĪŖHBr”£
£Ø2£©·“Ó¦¢Ł¢Ś¢Ü¢Ż¢ß¾łÓŠŌŖĖŲ»ÆŗĻ¼ŪµÄ±ä»Æ£¬ŹōÓŚŃõ»Æ»¹Ō·“Ó¦£¬·“Ó¦¢ŪŗĶ¢ŽŌŖĖŲ»ÆŗĻ¼Ūƻӊ·¢Éś±ä»Æ£¬²»ŹōÓŚŃõ»Æ»¹Ō·“Ó¦”£
£Ø3£©·“Ó¦¢ŽĪŖFeBr3ÓėKSCNČÜŅŗµÄ·“Ó¦£¬Ąė×Ó·½³ĢŹ½ĪŖFe3++3SCN-==Fe(SCN)3 ”£
£Ø4£©·“Ó¦¢ßŹĒĢśŌŚĖ®ÕōĘųÖŠ·¢ÉśµÄ·“Ӧɜ³ÉĖÄŃõ»ÆČżĢśŗĶĒāĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ3Fe+4H2O£Øg£©![]() Fe3O4+4H2£¬øĆ·“Ó¦ÖŠĒāŌŖĖŲ»ÆŗĻ¼Ū“Ó+1¼Ū±ä»ÆĪŖ0¼Ū£¬4H2O·“Ó¦×ŖŅʵē×ÓĪŖ 8mol£¬ĢśŌŖĖŲ“Ó0¼Ū±ä»ÆĪŖ+3/8¼Ū£¬ĆæĻūŗÄ 0.3molµÄA£ØFe£©£¬æÉ×ŖŅʵē×Ó0.8mol”£
Fe3O4+4H2£¬øĆ·“Ó¦ÖŠĒāŌŖĖŲ»ÆŗĻ¼Ū“Ó+1¼Ū±ä»ÆĪŖ0¼Ū£¬4H2O·“Ó¦×ŖŅʵē×ÓĪŖ 8mol£¬ĢśŌŖĖŲ“Ó0¼Ū±ä»ÆĪŖ+3/8¼Ū£¬ĆæĻūŗÄ 0.3molµÄA£ØFe£©£¬æÉ×ŖŅʵē×Ó0.8mol”£
£Ø5£©øł¾ŻÉĻŹö·ÖĪö£¬DĪŖFeBr3£¬Š”ĖÕ“ņĪŖNaHCO3£¬Fe3£«ÓėHCO3-·¢ÉśĖ«Ė®½āÉś³ÉĒāŃõ»ÆĢś³Įµķ”¢¶žŃõ»ÆĢ¼ŗĶĖ®£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖFe3++3HCO3-=Fe(OH)3”ż+3CO2”ü£»Fe3£«¾ßÓŠŃõ»ÆŠŌ£¬SO2¾ßÓŠ»¹ŌŠŌ£¬Fe3£«Äܽ«SO2Ńõ»Æ³ÉSO42-£¬¶ų×ŌÉķÉś³ÉFe2£«£¬øł¾ŻµĆŹ§µē×ÓŹŲŗć”¢µēŗÉŹŲŗćŗĶŌ×ÓŹŲŗćÅäĘ½£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+”£


 ĮéŠĒ¼ĘĖ抔“ļČĖĻµĮŠ“š°ø
ĮéŠĒ¼ĘĖ抔“ļČĖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½ü¶ĪŹ±¼ä£¬³ÆĻŹµÄ”°ŗĖĪ£»ś”±ŅżĘšĮĖČ«ĒņµÄÖõÄ棬Ęä½¹µćĪŹĢā¾ĶŹĒ³ÆĻŹŗĖµēÕ¾²ÉÓĆĒįĖ®¶Ń»¹ŹĒÖŲĖ®¶Ń£¬ÖŲĖ®¶ŃŗĖµēÕ¾ŌŚ·¢µēµÄĶ¬Ź±»¹æÉŅŌÉś²ś³öæɹ©ŃŠÖĘŗĖĪäĘ÷µÄīŠ£Ø![]() Pu£©£¬ĻĀĮŠÓŠ¹Ų
Pu£©£¬ĻĀĮŠÓŠ¹Ų![]() PuPuµÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
PuPuµÄĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A. ![]() Puŗ¬94øöÖŹ×Ó
Puŗ¬94øöÖŹ×Ó
B. ![]() PuÖŠµÄÖŠ×ÓŹżŗĶÖŹ×ÓŹżÖ®²īĪŖ51
PuÖŠµÄÖŠ×ÓŹżŗĶÖŹ×ÓŹżÖ®²īĪŖ51
C. ![]() PuÖŠŗ¬ÓŠ94øöÖŠ×Ó
PuÖŠŗ¬ÓŠ94øöÖŠ×Ó
D. ![]() Pu¾ßÓŠ·ÅÉäŠŌ
Pu¾ßÓŠ·ÅÉäŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ»śĪļĆüĆūÕżČ·µÄŹĒ£Ø £©
A£®![]() 2©ŅŅ»ł±ūĶé
2©ŅŅ»ł±ūĶé
B£®![]() ¼ä¶ž¼×±½
¼ä¶ž¼×±½
C£®CH3CH2CH2CH2OH 1©¶”“¼
D£®![]() 2©¼×»ł©2©±ūĻ©
2©¼×»ł©2©±ūĻ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij½šŹōµ„ÖŹÓėŅ»¶ØÅØ¶ČµÄĻõĖį·“Ó¦£¬¼ŁÉčֻɜ³Éµ„Ņ»»¹Ō²śĪļ”£µ±²Ī¼Ó·“Ó¦µÄµ„ÖŹÓė±»
»¹ŌĻõĖįµÄĪļÖŹµÄĮæÖ®±ČĪŖ2”Ć1Ź±£¬»¹Ō²śĪļŹĒ
A£®NO2 B£®NO C£®N2O D£®N2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×é½ųŠŠĮĖČēĶ¼ĖłŹ¾µÄŹµŃ飬É赌Ņ»²½HNO3µÄ»¹Ō²śĪļÖ»ÓŠNO£®Ļą¹Ų·ÖĪö²»ÕżČ·µÄŹĒ£Ø £©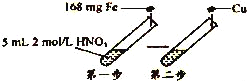
A£®µŚŅ»²½·“Ó¦ŗóČÜŅŗÖŠc£ØNO3©£©=1.5mol/L£ØŗöĀŌĢå»ż±ä»Æ£©
B£®µŚŅ»²½·“Ó¦ŗóČÜŅŗÖŠc£ØFe2+£©£ŗc£ØFe3+£©=1£ŗ1
C£®µŚŅ»²½æÉÉś³É±ź×¼×“æöĻĀµÄĘųĢå44.8 mL
D£®µŚ¶ž²½æÉČܽāĶ48mg
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°ŃVLŗ¬ÓŠMgSO4ŗĶK2SO4µÄ»ģŗĻČÜŅŗ·Ö³ÉĮ½µČ·Ż£¬Ņ»·Ż¼ÓČėŗ¬amolNaOHµÄČÜŅŗ£¬Ē”ŗĆŹ¹Ć¾Ąė×ÓĶźČ«³ĮµķĪŖĒāŃõ»ÆĆ¾£»ĮķŅ»·Ż¼ÓČėŗ¬bmolBaCl2µÄČÜŅŗ£¬Ē”ŗĆŹ¹ĮņĖįøłĄė×ÓĶźČ«³ĮµķĪŖĮņĖį±µ”£ŌņŌ»ģŗĻČÜŅŗÖŠ¼ŲĄė×ÓµÄÅضČĪŖ
A£®![]() B£®
B£®![]() C£®
C£®![]() D£®
D£®![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. µē½āČŪČŚĀČ»ÆÄĘæÉÖĘ½šŹōÄĘ
B. ÄĘÓėŃõĘų·“Ó¦µÄ²śĪļÓė·“Ó¦Ģõ¼žĪŽ¹Ų
C. ClO2æÉÓĆÓŚ×ŌĄ“Ė®µÄĻū¶¾
D. ”°ĀČ¼ī¹¤Ņµ”±ŹĒÖøµē½āŹ³ŃĪĖ®ÖĘČ”ĀČĘųµČ²śĘ·µÄ¹¤Ņµ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A£®ŗ¬ÓŠ¹²¼Ū¼üµÄ»ÆŗĻĪļŅ»¶ØŹĒ¹²¼Ū»ÆŗĻĪļ
B£®ŌŚ¹²¼Ū»ÆŗĻĪļÖŠŅ»¶Øŗ¬ÓŠ¹²¼Ū¼ü
C£®ŗ¬ÓŠĄė×Ó¼üµÄ»ÆŗĻĪļŅ»¶ØŹĒĄė×Ó»ÆŗĻĪļ
D£®Ąė×Ó»ÆŗĻĪļÖŠæÉÄÜŗ¬ÓŠ¹²¼Ū¼ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚŌŖĖŲA”¢B”¢C”¢D”¢EµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬AŗĶCĶ¬×壬BŗĶDĶ¬×壬CĄė×ÓŗĶBĄė×Ó¾ßÓŠĻąĶ¬µÄµē×Ó²ć½į¹¹£¬AŗĶB”¢D”¢E¾łÄÜŠĪ³É¹²¼ŪŠĶ»ÆŗĻĪļ”£AŗĶBŠĪ³ÉµÄ»ÆŗĻĪļŌŚĖ®ÖŠ³Ź¼īŠŌ£¬CŗĶEŠĪ³ÉµÄ»ÆŗĻĪļŌŚĖ®ÖŠ³ŹÖŠŠŌ£®»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĪåÖÖŌŖĖŲÖŠ£¬Ō×Ó°ė¾¶×ī“óµÄŹĒ £¬·Ē½šŹōŠŌ×īĒæµÄŹĒ (ĢīŌŖĖŲ·ūŗÅ)£»
£Ø2£©ÓÉAŗĶB”¢D”¢EĖłŠĪ³ÉµÄ¹²¼ŪŠĶ»ÆŗĻĪļÖŠ£¬ČČĪČ¶ØŠŌ×ī²īµÄŹĒ____________(ÓĆ»ÆѧŹ½±ķŹ¾)£»
£Ø3£©AŗĶEŠĪ³ÉµÄ»ÆŗĻĪļÓėAŗĶBŠĪ³ÉµÄ»ÆŗĻĪļ·“Ó¦£¬²śĪļµÄµē×ÓŹ½ĪŖ____________£»
£Ø4£©EµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄ»ÆѧŹ½ĪŖ____________£»
£Ø5£©µ„ÖŹCŌŚæÕĘųÖŠČ¼ÉյIJśĪļ“ęŌŚµÄ»Æѧ¼üĄąŠĶĪŖ £»Ęä·“Ó¦»Æѧ·½³ĢŹ½ĪŖ £»
£Ø6£©µ„ÖŹEÓėĖ®·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com