

| ||
| ||


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
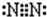
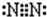
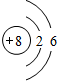
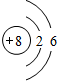
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
| ||
| ||
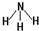
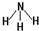
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市八校高一下学期期末联考化学试卷(带解析) 题型:填空题
(11分)(Ⅰ)A、B、C和D代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13;
②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸。
试根据以上叙述回答:
(1)B单质的电子式为 ,画出C元素的原子结构示意图 ;
(2)下列环境问题与B与C形成的化合物有关的是 ;
A.温室效应 B.光化学烟雾 C.酸雨 D.PM2.5
(3)A、B、C和D四种元素可形成一化合物,其原子个数之比为8∶2∶4∶1。该化合物属于 (填晶体类型)。
(Ⅱ)现有下列短周期元素相关性质的数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | | +2 | +1 | +5 | +7 | +1 | +5 |
| 最低负化合价 | -2 | | | -3 | -1 | | -3 |
查看答案和解析>>
科目:高中化学 来源:2014届天津市高三上学期第一次月考化学试卷(解析版) 题型:填空题
生铁中一般含有化合物B,B只有两种元素组成,它的含量、形状、分布对生铁性能影响很大,使生铁硬而脆,不宜进行机械加工。已知:(1)E、F、H、I、P常温下为气体,H、I、P为单质,E是一种红棕色气体。(2)反应①②均为制备理想的绿色水处理剂Na2FeO4的方法,其中反应①在生成Na2FeO4同时还生成NaNO2和H2O。各物质之闻的转化关系如下图所示f图中部分生成物没有列出)。
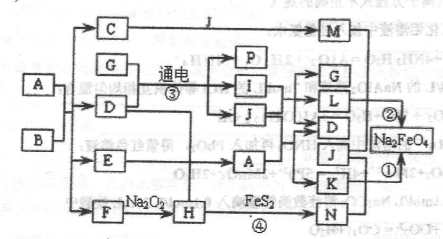
请填写以下空白:
(1)用电子式表示F的形成过程_________________________________________
(2)按要求完成下列反应:__________________________________________
反应③的离子方程式为________________________________________
反应①的化学方程式为________________________________________
(3)反应②中氧化剂与还原剂的物质的量比为__________________________________
反应④中的氧化产物的化学式为_______________________________________
(4)实验室中检验C溶液中金属阳离子的常用方法是________________________
(5)如果A与B反应时生成E与F的物质的量比为13:1,则化合物B的化学式为__________
查看答案和解析>>
科目:高中化学 来源:2014届浙江省宁波市八校高一下学期期末联考化学试卷(解析版) 题型:填空题
(11分)(Ⅰ)A、B、C和D代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13;
②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸。
试根据以上叙述回答:
(1)B单质的电子式为 ,画出C元素的原子结构示意图 ;
(2)下列环境问题与B与C形成的化合物有关的是 ;
A.温室效应 B.光化学烟雾 C.酸雨 D.PM2.5
(3)A、B、C和D四种元素可形成一化合物,其原子个数之比为8∶2∶4∶1。该化合物属于 (填晶体类型)。
(Ⅱ)现有下列短周期元素相关性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
|
最高正化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
最低负化合价 |
-2 |
|
|
-3 |
-1 |
|
-3 |
试回答下列问题:
(1)元素⑤在周期表中的位置 ;元素②的单质与CO2反应的化学方程式 ,该单质可通过电解法制得,下列金属中人类最早开发和利用的是 ;
A.铁 B.铝 C.金 D.铜
(2)元素④与元素⑦相比较,气态氢化物较稳定的是 (填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原子均达到8电子稳定结构的化合物是 。(写化学式)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省宁波市八校联考高一(下)期末化学试卷(解析版) 题型:填空题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低负化合价 | -2 | -3 | -1 | -3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com